离子方程式BaCO3+2H+=CO2↑+H2O+Ba2+中H+不能代表的物质是
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
| A.①③ | B.①④⑤ | C.①⑤ | D.②④⑤ |
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。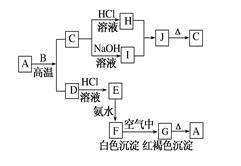
(1)写出下列物质的化学式:
A:_______,E: ______,J:_______,G:_______。
(2)按要求写方程式:
A与B在高温条件下生成C和D的化学方程式:______________________;
F在空气中转化为G的化学方程式:________________________________;
C转化为I的离子方程式:________________________________________。
下列离子反应方程式正确的是
A.碳酸氢钠溶液跟过量的饱和石灰水反应  |
B.向NaHSO4溶液中滴加Ba(OH)2溶液显中性 |
C.氯化亚铁溶液中通入氯气  |
D.苛性钾溶液中加入稀盐酸  |
将铁投入到稀硝酸溶液中,会发生如下反应:
Fe + 4HNO3(稀) = Fe (NO3)3 + NO↑ + 2H2O
(1)用双线桥法标出电子转移的方向和数目
(2)已知反应过程中消耗了28g铁,则转移电子的物质的量为 ,被还原的硝酸的物质的量为 。
(3)请将以上反应改写为离子方程式 。
下列反应的离子方程式错误的是
| A.向碳酸氢钙溶液中加过量氢氧化钠Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合 Ba2++OH-+HCO3-=BaCO3↓+H2O |
| C.氯化铝与过量氨水反应 Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| D.过量CO2通入氢氧化钡的稀溶液中 CO2+OH-=HCO3- |
下列方程式正确的是
A.AlCl3 溶液中加入过量氨水: |
B.碳酸的电离方程式: |
C.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: |
D.向Fe(NO3)2稀溶液中加入盐酸: |
如图所示为“铁链环”结构,图中两环相交部分A、B、C、D表示物质间的反应。下列对应部分反应的离子方程式书写不正确的是
A.Cl2+2OH-=Cl-+ClO-+H2O
B.Cu2++2OH-=Cu(OH)2↓
C.Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓
D.OH-+HCO3-=H2O+CO32-
按要求作答:
(1)石灰石与稀硝酸反应的离子方程式:_____________________________
(2)硫酸铜溶液与氢氧化钾溶液反应的离子方程式:_____________________
(3)写出HCl只做氧化剂的反应化学方程式:______________________________
(4)写出碳单质做还原剂的反应化学方程式:________________________________
下列电离方程式中正确的是
A.NaHSO4溶于水:NaHSO4 Na++H++SO Na++H++SO |
| B.次氯酸电离:HclO === ClO-+H+ |
C.HF溶于水:HF+H2O  H3O++F- H3O++F- |
D.NH4Cl溶于水:NH+H2O  NH3·H2O+H+ NH3·H2O+H+ |
如图表示各物质之间的转化关系。已知D、E、Z是中学化学常见的单质,其他都是化合物。 Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。M是可溶性的盐。除反应①外,其他反应均在水溶液中进行。 请回答下列问题。
(1)G的化学式为______________________________________
(2)X的电子式为______________________________________
(3)写出反应①的化学方程式____________________________
(4)写出反应的②离子方程式____________________________
在一定温度下,冰醋酸(即纯醋酸)加水稀释过程中,溶液的导电能力如下图所示,则:

(1)“O”点导电能力为0的理由是_________________________。
(2)用湿润的pH试纸测量a处溶液的pH,测量结果_________(偏大、偏小或不变)
(3)比较a、b、c三点的下列数据大小或等量关系:(如a>b>c、c=a>b、a=b=c等)
①pH:__________ ;
②醋酸的电离度:_________ ;
③醋酸的电离平衡常数:__________ ;
④a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:___________。
(4)若使c点溶液中c(CH3COO―)增大,c(H+)减小,可采用的措施有(答二类不同的物质):
①___________________②_____________________。
(5)在稀释过程中,随着c(CH3COOH)的降低,下列始终保持增大趋势的量是 。
| A.c(H+) | B.H+个数 | C.CH3COOH个数 | D.c(H+)/c(CH3COOH) |
下列反应的离子方程式正确的是
| A.钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B.氢氧化钡溶液跟稀硫酸反应 : Ba2+ + OH- + H++ SO42- = BaSO4↓+ H2O |
| C.铁粉加入稀硫酸中:2Fe + 6H+=2Fe3+ + 3H2↑ |
| D.过氧化钠与水反应: 2Na2O2+2H2O=4Na++4OH-+O2↑ |
下列离子方程式正确的是
| A.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++ 2I-= 2Fe2++ I2 |
| B.氧化铝溶解在NaOH溶液中:3H2O + Al2O3 + 2OH-=2[Al(OH)4]- |
| C.硫酸铝溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全 Al3+ + SO42-+ Ba2+ +3OH-= BaSO4 ↓ + Al(OH)3↓ |
| D.在漂白粉配制成的溶液中通入SO2:Ca2+ + 2ClO-+ SO2 + H2O = CaSO3↓+ 2HClO |
(Ⅰ)室温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NAOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 |
HA的物质的量 浓度(mol/L) |
NAOH的物质的 量浓度(mol/L) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=A |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸?
(2)乙组混合溶液中C(A-)和C(NA+)的大小关系是
A.前者大 B.后者大
C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
C(NA+)-C(A-)=________mol/L。
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
H2B===H++HB- HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的NA2B溶液中,下列粒子浓度关系式正确的是________。
A.C(B2-)+C(HB-)=0.1 mol/L
B.C(B2-)+C(HB-)+C(H2B)=0.1 mol/L
C.C(OH-)=C(H+)+C(HB-)
D.C(NA+)+C(OH-)=C(H+)+C(HB-)
(III)已知:25 ℃时,Ksp(BASO4)=1×10-10,Ksp(BACO3)=1×10-9。
(6)医学上进行消化系统的X射线透视时,常使用BASO4作内服造影剂。胃酸酸性很强(pH约为1),但服用大量BASO4仍然是安全的,BASO4不溶于酸的原因是(用溶解平衡原理解释)___________________________。
万一误服了少量BACO3,应尽快用大量0.5 mol/L NA2SO4溶液给患者洗胃,如果忽略洗胃过程中NA2SO4溶液浓度的变化,残留在胃液中的BA2+浓度仅为_____mol/L。
钡盐生产过程中排出大量钡泥【主要含有BaCO3、BaSO3、Ba(FeO2)2等】,某工厂本着资源利用和降低生产成本的目的。在生产BaCO3同时,充分利用钡泥来制取Ba(NO3)2晶体及其它副产品,其部分工艺流程如下:

已知: ①Fe(OH)3和Fe(OH)2完全沉淀时溶液的pH分别为3.2和9.7
②Ba(NO3)2在热水中的溶解度大, 在冷水中的溶解度小
③Ksp(BaSO4)=1.1×10-10 Ksp(BaCO3)=5.1×10-9
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量饱和的Na2CO3溶液中充分搅拌、过滤、洗涤。用离子方程式说明该提纯的原理____________。
(2)上述流程中Ba(FeO2)2与HNO3溶液反应生成两种盐,反应的化学方程式为_______。
(3)结合本厂生产实际X试剂应选下列中的_____。
| A.BaCl2 | B.BaCO3 | C.Ba(NO3)2 | D.Ba(OH)2 |
(4)废渣2为________。
(5)操作III为_______。
(6)过滤III后的母液应循环到容器______中(选填a、b、c) 。
(7)称取w克的晶体样品溶于蒸馏水中加入足量的稀硫酸,反应后经一系列操作称重所得沉淀质量为m克,则该晶体的纯度可表示为______________。