二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。回答下列问题:
(1)二氧化碳加氢制甲醇的总反应可表示为:
该反应一般认为通过如下步骤来实现:
①
②
总反应的 _______ ;若反应①为慢反应,下列示意图中能体现上述反应能量变化的是________(填标号),判断的理由是_______。
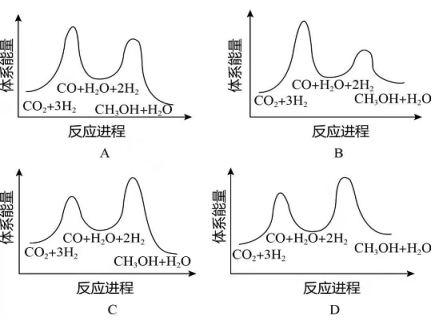
(2)合成总反应在起始物 时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为 ,在 ℃下的 、在 下的 如图所示。
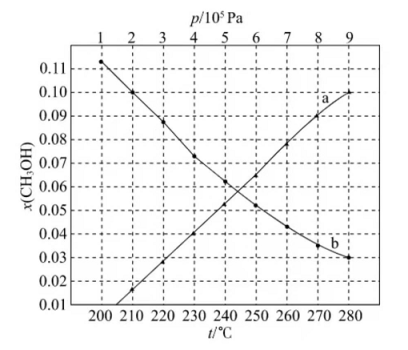
①用各物质的平衡分压表示总反应的平衡常数,表达式 ________;
②图中对应等压过程的曲线是________,判断的理由是_________;
③当 时, 的平衡转化率 __________,反应条件可能为________或_______。
作为一种绿色消毒剂,H2O2在公共卫生事业中发挥了重要的作用。已知反应:H2O2(l)═H2O(1) O2(g)△H=﹣98 kJ•mol﹣1 K=2.88×1020回答问题:
(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是 。
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l)═H2O(g) O2(g),放出大量气体,驱动火箭升空。每消耗34g H2O2,理论上 (填“放出”或“吸收”)热量 98kJ (填“大于”、“小于”或“等于”)。
(3)纯H2O2相对稳定,实验表明在54℃下恒温贮存2周,浓度仍能保持99%,原因是H2O2分解反应的 (填编号)。
a.△H比较小
b.K不够大
c.速率比较小
d.活化能比较大
(4)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起 作用。某组实验数据如下表:
t/min |
0 |
10 |
20 |
30 |
40 |
50 |
c(H2O2)/mol•L﹣1 |
0.70 |
0.49 |
0.35 |
0.25 |
0.17 |
0.12 |
0~30 min H2O2反应的平均速率v= mol•L•min﹣1
(5)H2O2 的一种衍生物K2S2O8,阴离子结构式为(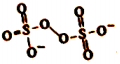 )。其中性溶液加热至沸后,溶液pH降低,用离子方程式表明原因: 。
)。其中性溶液加热至沸后,溶液pH降低,用离子方程式表明原因: 。