[化学选修——2:化学与技术]我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、FeO、Fe2O3等。一种利用粉煤灰制取氧化铝、硫酸铁溶液、二氧化硅的工艺流程如下:

(1)操作i的名称为 。
(2)工业上若需加快粉煤灰与NaOH溶液反应的浸出速率,可采取的措施有 (写两点即可)。
(3)写出固体A溶解在稀硫酸中所得溶液与H2O2反应的离子方程式 。
(4)以上流程中可以循环利用的物质是 (填化学式)。
(5)某科研小组用硫酸作为浸取液,浸取粉煤灰中的铝元素和铁元素,在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为 h;铝的浸取率与的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在相同时,浸取率最高的是 (填化学式)。


(6)Al/AgO电池是一种新型安全电池,广泛用于军事领域,其电池总反应为:2Al + 3AgO + 2OH―+ 3H2O 2[Al(OH)4]―+ 3Ag,则该电池工作时正极的电极反应方程式为 ,若电池产生6mol电子转移,整体上分析电池负极消耗的OH―物质的量最终为 mol。
2[Al(OH)4]―+ 3Ag,则该电池工作时正极的电极反应方程式为 ,若电池产生6mol电子转移,整体上分析电池负极消耗的OH―物质的量最终为 mol。
某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
① 缓慢向烧瓶中(见图)通入过量混合气进行“浸锰”操作,主要反应原理为: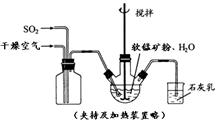
SO2+ H2O = H2SO3
MnO2+ H2SO3 = MnSO4+ H2O
(铁浸出后,过量的SO2 会将Fe3+还原为Fe2+)
② 向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③ 再用Na2CO3溶液调节pH为3.5左右,过滤。
④ 调节滤液pH为6.5~7.2 ,加入NH4HCO3 ,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
回答:
(1)“浸锰”反应中往往有副产物MnS2O6 的生成,温度对“浸锰”反应的影响如下图,为减少MnS2O6的生成,“浸锰”的适宜温度是 。
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是 。②中加入一定量纯MnO2粉末的主要作用是 ,相应反应的离子方程式为 。
表1:生成相应氢氧化物的pH
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
| 开始沉淀pH |
2.7 |
7.6 |
8.3 |
4.7 |
| 完全沉淀pH |
3.7 |
9.6 |
9.8 |
6.7 |
(3)③中所得的滤液中含有Cu2+,可添加过量的难溶电解质MnS除去Cu2+,经过滤,得到纯净的MnSO4。用平衡移动原理解释加入MnS的作用_________________。
(4)④中加入NH4HCO3 后发生反应的离子方程式是____________________。
(5)检验④中沉淀是否洗涤干净的方法是 。