下列说法中正确的是
| A.漂白粉的有效成分是Ca(CIO)2,应密封保存 |
| B.紫色石蕊试液中通入过量二氧化硫气体,溶液将先变红后褪色 |
| C.加热NH4Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成 |
D.SO2通入 溶液可生成 溶液可生成 沉淀 沉淀 |
某集气瓶内装的混合气体是红棕色,加入足量水,盖上玻璃片震荡,溶液变成橙黄色,气体颜色消失。再打开玻璃片,瓶中气体又变为红棕色。该混合气体可能是( )
| A.N2、NO2、Br2 | B.NO2、NO、N2 |
| C.NO2、O2、NO | D.N2、NO、Br2 |
下列有关Cl、N、S、C等非金属元素化合物的说法正确的是( )
| A.实验室制氯气产生的尾气可用澄清石灰水吸收 |
| B.实验室可用NaOH溶液处理NO2和HCl废气 |
| C.实验室可用浓硫酸干燥氨气 |
| D.金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
下列叙述不正确的是
| A.NH3易液化,液氨常用作制冷剂 |
| B.二氧化硫可以用来漂白某些有色物质,经久恢复原来有色物质的颜色 |
| C.新制氯水经光照一段时间pH减小 |
| D.稀HNO3和活泼金属反应时主要得到氢气 |
下列有关说法中正确的是
| A.NH3与HCl气体或CO2气体均不能共存 |
| B.铵盐溶液与NaOH 溶液混合后均会有NH3逸出 |
| C.SiO2能溶解在NaOH 溶液但不能溶解在氨水中 |
| D.硅、二氧化硅、硅酸、铵盐对热均很稳定 |
如图是一种试验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。则D瓶中盛有的溶液是
| A.浓H2SO4 | B.饱和NaCl溶液 |
| C.浓NaOH溶液 | D.浓NaBr溶液 |
Cu粉放入稀H2SO4中,无现象,当再加入一种盐后,Cu粉逐渐溶解,此盐是
| A.NaCl | B.CuSO4 | C.KNO3 | D.Na3PO4 |
有一硫酸和硝酸的混合溶液,取出20mL,加入足量BaCl2溶液,经过滤、洗涤、烘干后得沉淀9.32g;滤液与4mol/L的苛性钠溶液35mL恰好完全中和。试求:
(1)原混合溶液中硫酸和硝酸的物质的量浓度。
(2)另取10mL原溶液,加入0.96g铜粉共热,生成一氧化氮的体积为多少?(S.T.P.)
(3)另取10mL原溶液,加入1.92g铜粉共热,生成一氧化氮的体积为多少?(S.T.P.)
(4)向(3)反应后的溶液中加入多少毫升1mol/L硫酸就能将1.92g铜恰好完全溶解?
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示。已知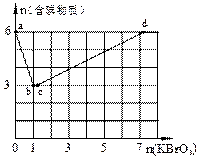
①BrO3-+6I一+6H+=3I2+Br-+3H2O;
②2BrO3- +I2 = 2IO3- + Br2;
请回答下列问题:
(1)b点时,KI反应完全,则消耗的氧化剂与还原剂物质的量之比为 ,还原产物是 。
(2)b→c过程中只有一种元素的化合价发生变化,写出该过程的离子反应方程式 。
(3)由反应②有同学由此得出氧化性:I2>Br2的结论,你认为是否正确,并说明理由
。
(4)含6 mol KI的硫酸溶液所能消耗n(KBrO3)的最大值
为 。
(5)加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示。先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解。阳极的电极反应式为 ;阴极观察到的现象是 ;
下列说法正确的是( )
| A.氯水和过氧化钠都具有漂白作用,其漂白原理相似 |
| B.硅和二氧化硅都是重要的半导体材料 |
| C.蛋白质和油脂的水解都是由高分子化合物生成小分子化合物的过程 |
| D.MgO和Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼镁、铝金属 |
将过量的气体通入到一种溶液中,一定能产生沉淀的是
①二氧化硫通入到硝酸钡溶液中 ②二氧化碳通入到偏铝酸钠溶液中 ③二氧化碳通入到氯化钙溶液中 ④氨气通入到氯化镁溶液中
| A.只有①②③ | B.只有①② | C.只有②③ | D.只有①②④ |
在复印室工作时会闻到一股特殊的气味,离复印机越近,该气味越浓.若用润湿的KI淀粉试纸接近该气体,则试纸会变蓝,则该物质的化学式是
| A.Cl2 | B.NO2 | C.O3 | D.N2 |
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1 个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,D+具有与Ne原子相同的电子层结构。
个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火,D+具有与Ne原子相同的电子层结构。
(1)试判断A、B、C、D四种元素的名称。
A__________,B______________, C___________,D 。
(2)由A、B、D三种元素 组成的化合物的电子式为
组成的化合物的电子式为  ,
,
其所包含的具体化学键型为 。
(3)用电子式表示A2B的形成过程 。
(4)如上图所示,在烧瓶中收集满CB2气体,用带导管(导管一端事先绑好一个气球)的胶塞塞紧,当打开胶塞迅速倒入浓的A、B、D三种元素组成的化合物的溶液后,立即塞紧胶塞振荡,可观察到气球膨胀的现象,请用离子方程式解释其原因:
关于下列氢化物的叙述中不正确的是 ( )
| A.一个D2O分子所含中子数为10 | B.NH3的结构式为 |
| C.热稳定性:HCl<HF | D.HCI的电子式为 |
(15分)
沿海地区有着丰富的海水资源,海水占地球总储水量的97.4﹪,海水是人类宝贵的自然资源,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海水资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
⑴请列举海水淡化的两种方法 、 。
⑵使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 .
⑶步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是: .
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
⑷在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
.
⑸电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是
| A.H2 | B.CO2 | C.空气 | D.O2 E.水蒸气 |
⑹苦卤(海水蒸发结晶分离出食盐后的母液)中含有较多的NaCl、MgCl2、KCl、MgSO4等物质.用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有
.