为了测定某铜银合金的组成,将30.0 g合金溶于80 mL 13.5 mol·L-1的浓硝酸中,待合金完全溶解后,收集到气体6.72 L(标准状况),并测得溶液中H+的物质的量浓度为1 mol·L-1,假设反应后溶液的体积仍为80 mL,计算:
(1)被还原的硝酸的物质的量。
(2)合金中银的质量分数。
下列有机物在一定条件下自身分子间能发生缩聚反应,而在适宜条件下分子内又能形成环状结构的是
A.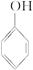 |
| B.CH2==CH—Cl |
C.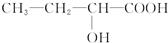 |
| D.HO(CH2)4CH2OH |
已知硫氰(SCN)2、氰气(CN)2和Cl2性质相似。试完成下列反应:
(1)(CN)2+NaOH→___________________________________________________________。
(2)MnO2+HSCN→
_____________________________________________________________。
自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析不正确的是( )
| A.CuS的溶解度小于PbS的溶解度 |
| B.CuSO4与ZnS反应的离子方程式是Cu2++S2-= CuS↓ |
| C.整个过程涉及的反应类型有氧化还原反应和复分解反应 |
| D.原生铜的硫化物和铜蓝都具有还原性 |
NA为阿伏加德罗常数,下述正确的是
| A.80 g硝酸铵含有氮原子数为2NA |
| B.1 L 1 mol·L-1的盐酸溶液中,所含氯化氢分子数为NA |
| C.标准状况下,11.2 L四氯化碳所含分子数为0.5NA |
| D.在铜与硫的反应中,1 mol铜失去的电子数为2NA |
在一定条件下可实现下图所示物质之间的变化
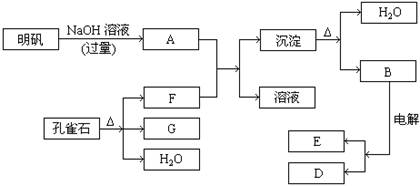
请填写以下空白:
(1)孔雀石的主要成份是CuCO3·Cu(OH)2(碱式碳酸铜)受热易分解。上图中的F是 。
(2)写出明矾溶液与过量的NaOH溶液反应的离子方程式
(3)图中所得G和D都为固体混合后在高温下可发生反应写出该反应化学方程式 。
(4)每生成1mol D同时生成 mol E。
向某溶液中加入BaCl2溶液,再加入稀硝酸,产生的白色沉淀不消失,下列叙述正确的是
A.溶液中一定含有 |
| B.溶液中一定含有Ag+ |
C.溶液中一定含有 |
D.溶液中可能含有 、 、 、Ag+中的某一种、两种或三种 、Ag+中的某一种、两种或三种 |
下列与有关非金属元素叙述以及推理结果不正确的是( )
①非金属性F>Cl,故将F2通入NaCl溶液中,发生反应为:F2 + 2Cl-= Cl 2 + 2F-
②非金属性F>Br,故酸性:HF>HBr
③非金属性S>As ,故前者的气态氢化物稳定性更强
④非金属性O>N,故O 2与H2化合比N2更容易
| A.②③ | B.③④ | C.①④ | D.①② |
下列说法正确的是 ( )
| A.因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐 |
| B.CO2通入水玻璃(Na2SiO3溶液)可以得到硅酸 |
| C.因为高温时SiO2与Na2CO3反应生成CO2,故硅酸的酸性比碳酸强 |
| D.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3 |
如图,A~D四种物质均含有同一种元素,A是非金属单质,D是最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是 ( )
①C ②N ③Si ④S ⑤Cl
A.①② B.②⑤ C.③④ D.②④
下列事实,不能说明氯元素的非金属性比硫元素强的是
| A.氯气比硫单质更易与氢气反应 | B.HClO4酸性比H2SO4强 |
| C.盐酸是强酸,氢硫酸是弱酸 | D.受热时,氯化氢比硫化氢稳定 |
下列有关化工生产和物质的性质应用,说法正确的是
| A.生产玻璃和水泥都要用到的原料是石灰石和黏土 |
| B.工业上金属Na、Mg、Al都是用电解熔融的氯化物制得的 |
| C.食盐、Br2、Mg(OH)2都可以从海水中提取 |
| D.氯气、漂白粉、明矾都可以用于自来水的消毒 |