现有铜、银合金14g与足量的某浓度的硝酸100mL发生反应,将生成的气体与1.12L(标况)氧气混合,通入足量的水中恰好全部吸收,反应后溶液体积仍为100mL。试通过计算回答下列问题:
(1)原固体混合物中铜和银的质量各是多少?
(2)若原硝酸溶液为浓硝酸,反应产生的气体是单一气体,则该反应中被还原的硝酸的物质的量是多少?
(3)合金完全溶解后,若生成的气体在标况下体积为2.24L,反应后溶液中c(H+)=7mol/L,则该混合气体中NO和NO2在标准状况下的体积分别是多少?原硝酸的浓度是多少?
A~H是纯净物或溶液中的溶质,其中A是日常生活中应用最广、用量最大的金属单质。它们之间有如下关系:(部分产物和反应条件略)
根据上述信息,回答下列问题:
(1)写出下列物质的化学式B ,E 。
(2)H和 SO2生成强酸F,此反应中氧化剂是 。
(3)写出①的离子方程式: 。
(4)写出②的化学方程式: 。
(5)C溶液中滴入NaOH溶液有何现象 。
所发生反应的化学方程式为___________________,____________________。
I实验室用加热固体氯化铵和氢氧化钙的混合物制取氨,反应的化学方程式为: 。所制得气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出适当选择,并将编号字母填入表中的空格处。
(1)装置: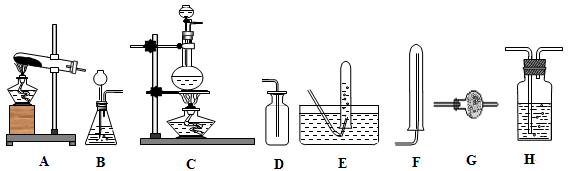
(2)试剂: a.NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰f.品红溶液 g.湿润的红色石蕊试纸
| 制取 气体 |
杂质气体 |
制取气体的 发生装置 |
除去杂质气体的净化装置 |
收集 装置 |
净化装置内 所用试剂 |
检验制得气 体所用试剂 |
| NH3 |
H2O(g) |
II如图所示,在干燥的圆底烧瓶里充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口。立即倒置烧瓶,使玻璃管插入盛有水的烧杯里(预先在水里滴入少量酚酞溶液)。打开橡皮管上的夹子,轻轻挤压滴管,使少量水进入烧瓶,可观察到的现象为:____ 。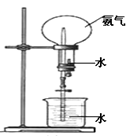
高铁酸钾(K2FeO4)具有极强的氧化性,可作为水处理剂和高容量电池材料。
(1)FeO42-与水反应的方程式为:4FeO42-+ 10H2O 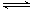 4Fe(OH)3 + 8OH-+ 3O2,
4Fe(OH)3 + 8OH-+ 3O2,
K2FeO4在处理水的过程中所起的作用是________。
(2)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为____________________________。
(3)将适量K2FeO4配制成c(FeO42-)=1.0×10-3 mol/L(1.0mmol/L)的试样,FeO42-在水溶液中的存在形态如右图所示。下列说法正确的是(填字母)。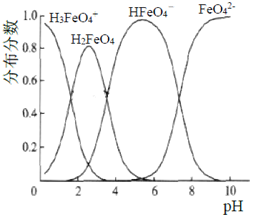
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4-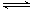 H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
H++FeO42-的电离平衡常数表达式为K=______________,其数值接近_______(填字母)。
A.10-2.5B.10-6C.10-7D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL1.0×10-3 mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,则理论上需控制溶液中Ca2+浓度至少为__________。
I.下图为相互串联的三个装置,试回答: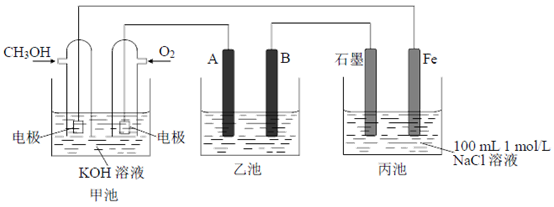
(1)若利用乙池在铁片上镀银,则B是_________(填电极材料),电极反应式是_________;应选用的电解质溶液是_____________。
(2)若利用乙池进行粗铜的电解精炼,则________极(填“A”或“B”)是粗铜,若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为_____________________。
(3)丙池滴入少量酚酞试液,电解一段时间___________(填“C”或“Fe”)极附近呈红色。
(4)写出甲池负极的电极反应式:________________________________。若甲池消耗3.2gCH3OH气体,则丙池中阳极上放出的气体物质的量为______________。
II.(5)请利用反应Fe +2Fe3+= 3Fe2+设计原电池。
设计要求:①该装置尽可能提高化学能转化为电能的效率;
②材料及电解质溶液自选,在图中做必要标注;
③画出电子的转移方向。
已知用硫酸酸化的草酸(H2C2O4)溶液能与KMnO4溶液反应。某化学小组研究发现,少量MnSO4可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)常温下,探究不同的初始pH和草酸溶液浓度对反应速率的影响,设计如下实验,则A=________,C=___________,E=___________
| 实验编号 |
温度 |
初始pH |
0.1mol/L草酸溶液体积/mL |
0.01mol/LKMnO4 溶液体积/mL |
蒸馏水体积/mL |
待测数据(混合液褪色时间/s) |
| ① |
常温 |
1 |
20 |
50 |
30 |
t1 |
| ② |
常温 |
A |
B |
C |
30 |
t2 |
| ③ |
常温 |
2 |
40 |
D |
E |
t3 |
(2)该反应的离子方程式_____________________________。
(3)若t1<t2,则根据实验①和②得到的结论是________________________。
(4)小组同学发现每组实验反应速率随时间的变化总是如图,其中t1~t2时间内速率变快的主要原因可能是:①__________________;②_________________。
(5)化学小组用滴定法测定KMnO4溶液物质的量浓度:取ag草酸晶体(H2C2O4•2H2O,摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定三次,平均消耗KMnO4溶液VmL。滴定到达终点的现象是:__________;实验中所需的定量仪器有__________(填仪器名称)。该KMnO4溶液的物质的量浓度为________mol/L。
25°C时某些弱酸的电离平衡常数Ka如下表,下列说法正确的是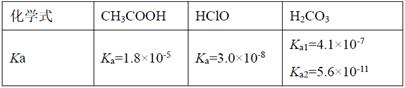
| A.相同pH的三种酸溶液,物质的量浓度由大到小的顺序为:c(HClO)>c(CH3COOH)>c(H2CO3) |
| B.在相同物质的量浓度的Na2CO3、NaClO、NaHCO3与CH3COONa四种钠盐中加水稀释,水解程度均增大,碱性均增强 |
| C.等物质的量浓度的NaClO和NaHCO3混合溶液中:c(Na+)=c(HClO)+c(ClO-)+c(HCO3-)+c(CO32-)+c(H2CO3) |
| D.向次氯酸钠溶液中通入少量二氧化碳气体的离子方程式为:2ClO-+CO2+H2O=CO32-+2HClO |
车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5 L密闭容器中加入NO和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量(n/mol)如下表:
| 物质 T/℃ |
活性炭 |
NO |
E |
F |
| 初始 |
3.000 |
0.10 |
0 |
0 |
| T1 |
2.960 |
0.020 |
0.040 |
0.040 |
| T2 |
2.975 |
0.050 |
0.025 |
0.025 |
(1)写出NO与活性炭反应的化学方程式 ;
(2)计算上述反应T1℃时的平衡常数K1= ;
(3)上述反应T1℃时达到化学平衡后再通入0.1molNO气体,则达到新化学平衡时NO的转化率为 ;
(4)右图为在T1℃达到平衡后在t2、t3、t4、t5时改变某一个反应条件,平衡体系中反应速率随时间变化的情况,且所改变的条件均不同。已知t3-t4阶段为使用催化剂。请判断该反应△H 0(填“>”或“<”)。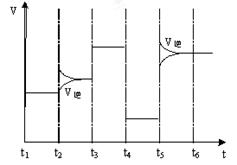
往含0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72 L(标准状况下)时立即停止,则在这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)()
(Ⅰ)A、B、C、D、E五种溶液分别为NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①将1LpH=3的A溶液分别与0.001mol/L xLB溶液、0.001mol/L yLD溶液充分反应至中性,x、y大小关系为:y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是_____________溶液
(2)用水稀释0.1mol/LB时,溶液中随着水量的增加而减小的是_____________(填写序号)
① ;②
;② ;③c(H+)和c(OH-)的乘积;④OH-的物质的量
;③c(H+)和c(OH-)的乘积;④OH-的物质的量
(3)OH-浓度相同的等体积的两份溶液A和E,分别和锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是_____________(填写序号)
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌粉物质的量A=E④反应过程的平均速率E>A
⑤A溶液里有锌粉剩余⑥E溶液里有锌粉剩余
(4)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解)溶液pH随温度变化如图中的_____________曲线(填写序号).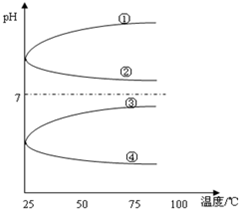
(5)室温下,向0.01mol/LC溶液中滴加0.01mol/LD溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为_____________.
(Ⅱ)如下图所示 ,横坐标为溶液的pH值,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题。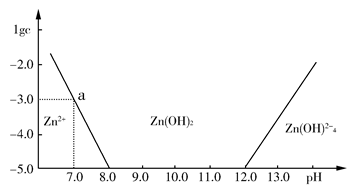
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:_______________。
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=_______________。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH值的范围是________________________。
足量铜与一定量浓硝酸反应后过滤,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,将这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得溶液中加入1 mol/L NaOH溶液至Cu2+恰好完全沉淀,将沉淀过滤、洗涤、干燥、灼烧后得到黑色固体,则所得黑色固体的质量是()
| A.12g | B.16g | C.24g | D.48g |
一块11.0 g的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2至溶液中无Fe2+存在,加热除去多余的H2O2,当加入200 mL 6 mol ·L―1 NaOH溶液时沉淀量达最大值,且所得沉淀质量为26.3 g,下列说法不正确的是()
| A.该合金中铁的质量为5.6g |
| B.合金与稀硫酸反应共生成0.45molH2 |
| C.该合金与足量的氢氧化钠反应,转移的电子0.6mol |
| D.所加的稀硫酸中含0.6molH2SO4 |
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是()
| A.O点溶液中所含溶质的化学式为NaOH、Na2CO3 |
| B.常温下,a点溶液显碱性 |
| C.标准状况下,通入CO2的体积为4.48L |
| D.原NaOH溶液的物质的量浓度为2.5mol/L |
A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图所示的关系,完成下列空白:
(1)向酚酞试液中加入化合物A的粉末,现象为_________________________。
(2)单质甲与化合物B反应的离子方程式为________________________5.05g单质甲-钾合金溶于200mL水生成0.075mol氢气,确定该合金的化学式为________________。
(3)向50mL某浓度的化合物C的溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积 V(HCl)的关系有下列图示两种情况。
①由A确定滴加前60mL的盐酸时,发生反应的离子方程式____________________。 (有几个写几个) 。
②由A图表明,原溶液通入CO2气体后,所得溶液中的溶质的化学式为___________。
③原化合物C溶液的物质的量浓度为____________________。
④由A、B可知,两次实验通入的CO2的体积比为__________。