某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。

请回答:
I.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu做电极的是 (填字母序号)。
| A.铝 | B.石墨 | C.银 | D.铂 |
(2)N极发生反应的电极反应式为 。
(3)实验过程中,SO42- (填“从左向右”、“从右向左”或“不”)移动;
滤纸上能观察到的现象有 。
II.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH (填“增大” 、“减小”或“不变”)。电解过程中,Y极发生的电极反应为Fe-6e-+8OH-==FeO42-+4H2O 和 。
(5)若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
电解原理在化学工业上有广泛应用。一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液。
①电解池中X极上的电极反应式为_________________,在X极附近观察到的现象是_______________。
②Y电极上的电极反应式为________________,检验该电极反应产物的方法是_______________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液
①X电极的材料是_________________,电极反应式为_______________。
②Y电极的材料是 ________________,电极反应式为________________。
某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:

(1)该反应的化学方程式为:
(2)反应开始至2min,用X表示的平均反应速率为:
(3)下列叙述能说明上述反应达到化学平衡状态的是 (填字母)
A.混合气体的总物质的量不随时间的变化而变化
B.单位时间内每消耗3mol X,同时生成2mol Z
C.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入a mol H2(g)和bmol I2,发生反应H2 (g)+ I2 (g)=2HI(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“减小”或“不变”)
① 降低温度: ②保持容器的体积不变,增加X(g)的物质的量:
③ 增大容器的体积: ④容器容积不变,通入氖气________________。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:

①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗2~3次后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使凹液面处于"0"刻度以下的位置,记下读数;
②将锥形瓶用蒸馏水洗净后,直接从碱式滴定管中放入20.00mL待测溶液到锥形瓶中;
③将酸式滴定管用蒸馏水洗净后,立即向其中注入0.2000mol/L标准稀硫酸溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;
④向锥形瓶中滴入几滴酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗硫酸的体积为V1mL;
⑤重复以上过程,但在滴定过程中向锥形瓶加入5mL蒸馏水,测得所耗稀硫酸为V2mL。
试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)上述操作步骤中错误的一步是 (填步骤编号)。由此造成的测定结果 (填“偏高”、“偏低”或“无影响”)。
(4)某次滴定时的滴定管中的液面如图,则其读数为 mL。若记录读数时,起始时仰视,终点时俯视,则所测溶液浓度会 滴定前向锥形瓶中加入10 mL蒸馏水,其余操作正常,则所测溶液浓度会 (填“偏高”、“偏低”或“无影响”)。

(5)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准硫酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.45 |
| 第二次 |
20.00 |
4.00 |
29.05 |
| 第三次 |
20.00 |
3.00 |
30.00 |
| 第四次 |
20.00 |
2.00 |
27.00 |
请计算待测烧碱溶液的浓度为 mol/L。
甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”)。
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g)  CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
E.混合气体的颜色保持不变 F.混合气体的平均相对分子质量不随时间而变化
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)=CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 |
Cu2+ |
H+ |
Cl﹣ |
SO42﹣ |
| c/mol·L﹣1 |
0.5 |
2 |
2 |
0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的质量为____________.
工业电解饱和食盐水模拟装置的结构如图所示:

(1)写出电解饱和食盐水的化学方程式 ,该工业称为 工业
(2)实际生产中使用的盐往往含有一些杂质,在电解食盐水之前,需要提纯食盐水。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是
①过滤 ②加过量的NaOH溶液 ③加适量的盐酸 ④加过量的Na2CO3溶液 ⑤加过量的BaCl2溶液
| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤②④③① |
(3)在该装置中写出装NaOH溶液试管中所发生的化学反应方程式(并用双线桥表示电子的转移的方向和数目) 。
实验室有一包白色固体,可能含有Na2CO3、NaHCO3和NaCl中的一种或多种。下列根据实验事实得出的结论正确的是
| A.取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 |
| B.取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 |
| C.取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl |
| D.称取3.80g固体,加热至恒重,质量减少了0.620g。用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |
化学理论在元素单质及其化合物反应中应用广泛.
(1)在一定条件下,可逆反应mA nB+pC△H,达到平衡状态.
nB+pC△H,达到平衡状态.
①若A、B、C都是气体,增大压强,平衡向正反应方向移动,则m n+p(填“大于”、“小于”或“等于”).
②其他条件不变,加热后A的质量减小,则反应△H 0(填“大于”、“小于”或“等于”).
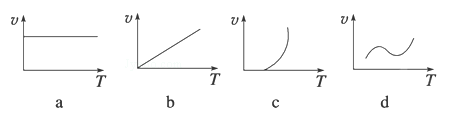
(2)某些金属氧化物(如FeXOY)粉末和Al粉在镁条的引燃下可以发生铝热反应,下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是 (填序号)
(3)一定温度下,发生反应:FeO(s)+CO(g) Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如下表:
Fe(s)+CO2(g)△H.已知该反应在不同温度下的平衡常数如下表:
| 温度/℃ |
1000 |
1100 |
| 平衡常数 |
0.68 |
0.50 |
请回答下列问题:
①该反应的△H 0(填“>”、“<”或“=”).
②T℃时,将FeO(s)和CO(g)各3.0mol加入10L的密闭容器中,反应达到平衡后,测得CO转化率为W1,c(CO2)=0.15mol•L﹣1,则温度T (填“高于”、“低于”、“等于”)1000,若此时保持其它条件不变再充入2.0mol CO(g),再达平衡时测得CO转化率为W2,则W1 W2(填“>”、“<”或“=”) .
二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:

请填空:
(1)一定条件下,反应室1中发生反应CH4(g)+H2O(g)═CO(g)+3H2(g)△H>0.其它条件不变,只降低温度,逆反应速率将 (填“增大”、“减小”或“不变”).
(2)图1中反应室3(容积可变的密闭容器)中0.2mol CO与0.4mol H2在催化剂作用下发生可逆反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如图2所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图2所示,则:

①P1 P2(填“<”、“>”或“=”).
②在压强P1下,100℃时反应达到化学平衡,反应室3的容积变为2L,此时CO平衡常为 , 若温度不变,再加入1.0mol CO后重新达到平衡,CO的平衡转化率 (填“增大”、“不变”或“减小”).
③保持容积为2L不变,温度100℃不变,向反应室3中再通入0.2mol CO与0.4mol H2,CO的平衡转化率 (填“增大”、“不变”或“减小”).
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在一定体积的恒容密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.

(1)从反应开始到平衡,氢气的平均反应速率v(H2)= mol/(L•min);
(2)氢气的转化率= ;
(3)下列措施中能使平衡体系中 减少的是 .
减少的是 .
A.将H2O(g)从体系中分离出去
B.充入He(g),使体系压强增大
C.升高温度
D.再充入1molH2
(4)下列不能表示反应达到平衡状态的是
A.体系压强不再改变
B.混合气体的密度不再改变
C.容器内的温度不再改变
D.混合气体的平均分子质量不再改变
E.V(CO2):V(H2O)=1:1
F.混合气体的总物质的量不再改变
(1)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:
2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率,某同学设计实验如表所示:
| |
0.01mol•L﹣1 KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol•L﹣1 Na2SO3溶液的体积/mL |
H2O的体积 /mL |
实验 温度 /℃ |
溶液出现蓝色时所需时间/s |
| 实验1 |
5 |
V1 |
35 |
25 |
|
| 实验2 |
5 |
5 |
40 |
25 |
|
| 实验3 |
5 |
5 |
V2 |
0 |
|
该实验的目的是 ,表中V1= mL.
(2)可逆反应C(s)+H2O(g) H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.
H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.
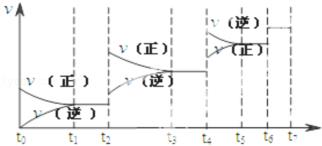
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是 、 ;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
碘是人体不可缺少的元素,为了防止碘缺乏,现在市场上流行一种加碘盐,就是在精盐中添加一定量的KIO3进去。某研究小组为了检测某加碘盐中是否含有碘,查阅了有关的资料,发现其检测原理是: 在溶液中 KIO3+5KI+3H2SO4=3I2+3H2O+3K2SO4
(1)用双线桥表示该反应中电子转移的方向和数目
该反应中还原产物与氧化产物的物质的量比是__________,0.2mol KIO3参加反应时转移电子__________mol
(2)实验结束后分离I2和K2SO4溶液所用的试剂是________
A.CCl4 B.酒精 C.Na2SO4溶液 D.食盐水
所用的分离方法是 ,所用主要玻璃仪器是
(3)上面实验中用到一定物质的量浓度的稀硫酸,若配制1 mol/L的稀硫酸溶液480mL,需用18mol/L浓H2SO4 mL,配制中需要用到的主要玻璃仪器是(填序号) .
A 100mL量筒 B 托盘天平
C 玻璃棒 D 100mL容量瓶
E 50mL 量筒 F 胶头滴管 G 烧杯 H 500mL容量瓶
(4)下面操作造成所配稀硫酸溶液浓度偏高的是___________
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视液面
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
某强酸性溶液X,含有Ba2+、Al3+、SiO32-、NH4+、Fe2+、Fe3+、CO32-、SO42-、NO3-中的一种或几种离子,取溶液进行连续实验,能实现如下转化:
依据以上信息,回答下列问题:
(1)上述离子中,溶液X中肯定含有的是:________________;不能肯定的是:_______________。对不能确定是否存在的离子,可以另取X溶液于一支试管中,选择下列试剂中的一种加入X溶液中,根据现象就可判断,则该试剂是:_________。(选填:①NaOH溶液,②酚酞试剂,③石蕊试剂,④pH试纸,⑤KSCN溶液,⑥KMnO4溶液)
(2)气体F的电子式为:_______________,实验中,可以观察到反应②的现象是:__________________。
(3)写出步骤①所有发生反应的离子方程式________________________、___________________。
人体血液里Ca2+离子的浓度一般采用g/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度:
【配制KMnO4标准溶液】下图是配制50mLKMnO4标准溶液的过程示意图。
(1)上述过程中有两处错误,请你观察图示,判断其中不正确的操作是(填序号)____________;
(2)如果按照图示的操作配制溶液,所得的实验结果将____________(填偏大或偏小)。
【测定血液样品中Ca2+的浓度】抽取血样20.00mL,经过上述处理后得到草酸,再用硫酸酸化的0.020mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL KMnO4溶液。
(3)滴定时,盛放高锰酸钾器名称为________________,确定反应达到终点的现象________________。
(4)草酸跟酸性KMnO4溶液反应的离子方程式为:_______________________。
(5)根据所给数据计算血液样品中Ca2+离子的浓度为________mg/cm3。
分某化学兴趣小组同学展开对漂白剂亚氯酸钠 (NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用图10所示装置进行实验。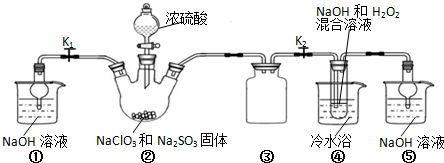
(1)装置③的作用是____________________。
(2)装置②中产生ClO2的化学方程式为_________________________;装置④中制备NaClO2的化学方程式为______________________。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③____________;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+===2H2O+2I2+Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00 mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-===2I-+S4O62-)。
(4)达到滴定终点时的现象为___________________。
(5)该样品中NaClO2的质量分数为_______________(用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为________________。