由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: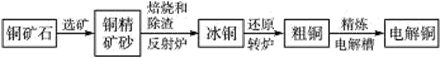
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1 000 ℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是_____________、____________________,反射炉内生成炉渣的主要成分是____________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1 200 ℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是__________________、____________________;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极______(填图中的字母);在电极d上发生的电极反应式为________________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为________。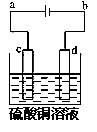
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加人3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。则下列叙述中不正确的是( )
| A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mL |
| B.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol |
| C.参加反应的金属的总质量为9.6 g>m>3.6 g |
| D.当金属全部溶解时收集到NO气体的体积一定为2.24 L。 |
在一密闭容器中发生反应N2+3H2 2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
2NH3,△H<0达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示:回答下列问题:
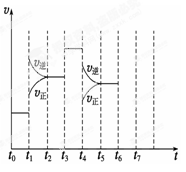
(1)处于平衡状态的时间段是 (填选项)。
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是_____(填选项)。
A.增大压强
B.减小压强
C.升高温度
D.降低温度
E.加催化剂
F.充入氮气
t1时刻 ;t3时刻 ;t4时刻 。
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是 (填选项)。
A.t0~t1 B.t2~t3 C.t3~t4 D.t5~t6
(4)如果在t6时刻,从反应体系中分离出部分氨,t7时刻反应达到平衡状态,请在图中画出反应速率的变化曲线。
(5)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 。
研究硫元素及其化合物的性质具有重要意义。
Ⅰ.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:(熔点:SO2 -76.1℃,SO3 16.8℃;沸点:SO2 -10℃,SO3 45℃)
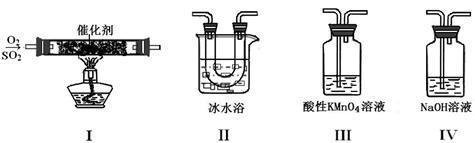
(1)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是_________ ;装置III中溶液逐渐褪色,证明二氧化硫具有 性。
(2)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40 mL 3.0mol/L NaOH溶液,反应后增重5.12 g,则装置Ⅳ中发生反应的化学方程式是 。
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成。向该试管中加入足量_____(填字母),便能产生沉淀。
| A.硫化钠溶液 | B.氨水 | C.盐酸 | D.硝酸钾溶液 |
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
称取铁钉(碳素钢)6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。
(4)甲同学认为X中除Fe3+外还可能含有Fe2+。若要确认其中的Fe2+应选用________(选填序号)。
a.KSCN溶液和氯水
b.氢氧化钠溶液
c.酸性KMnO4溶液
d.铁粉和KSCN溶液
(5)乙同学取784 mL(标准状况)气体Y通入足量H2O2水溶液中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积百分数为________ 。(保留小数点后一位)
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和C02气体,产生C02的理由是_______________ (用化学方程式表示)。
为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验I:反应产物的定性探究
按下图装置(固定装置已略去)进行实验
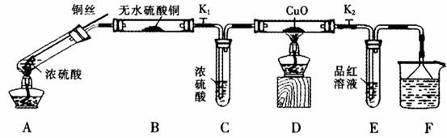

(1)A中反应的化学方程式为: 。
(2)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是_____________。
(3)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
(4)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为 。
(5)某同学想用SO2气体进行喷泉实验(装置如图所示),烧杯中的溶液可以为 (填序号)
a.NaOH溶液 b.饱和NaHSO3溶液 c.氯水 d. KMnO4溶液
实验Ⅱ:反应产物的定量探究
(6)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00 mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用b mol·L-1Na2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为ag,则硫酸铜的产率为 (已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)。
SO2是常见的大气污染物,燃煤是产生SO2的主要原因。工业上有多种方法可以减少SO2的排放。
(1)往煤中添加一些石灰石,可使燃煤过程中产生的SO2转化成硫酸钙。该反应的总化学方程式是___________________________________。
(2)可用多种溶液做燃煤烟气中SO2的吸收液。
①分别用等物质的量浓度的Na2SO3溶液和NaOH溶液做吸收液,当生成等物质的量NaHS03时,两种吸收液体积比V(Na2SO3): V(NaOH)= 。
②NaOH溶液吸收了足量的:SO2后会失效,可将这种失效的溶液与一定量的石灰水溶液充分反应后过滤,使NaOH溶液再生,再生过程的离子方程式是 。
(3)甲同学认为BaCl2溶液可以做SO2的吸收液。为此甲同学设计如下实验(夹持装置和加热装置略,气密性已检验)。反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B中有白色沉淀。甲同学认为B中白色沉淀是SO2与BaCl2溶液反应生成的BaSO3,所以BaCl2溶液可做SO2吸收液。
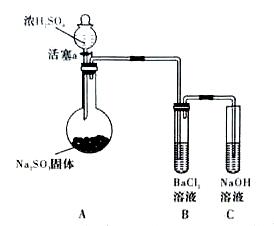
乙同学认为B中的白色沉淀是BaSO4,产生BaSO4的原因是:
①A中产生的白雾是浓硫酸的酸雾,进入B中与BaCI2溶液反应生成BaSO4沉淀。
② 。
为证明SO2与BaCl2溶液不能得到BaSO3沉淀,乙同学对甲同学的实验装置做了如下改动并实验(夹持装置和加热装置略,气密性已检验):
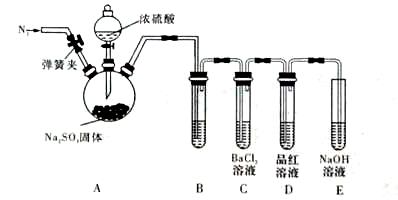
反应开始后,A中Na2SO3固体表面有气泡产生同时有白雾生成;B、C试管中除了有气泡外,未见其它现象;D中红色褪去。
③试管B中试剂是 溶液;滴加浓硫酸之前的操作是 。
④通过甲、乙两位同学的实验,得出的结论是 。
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
实验一: 制备NaClO溶液(实验装置如图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有 (填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是 。
(3)利用中和滴定反应原理测定反应后锥形瓶中混合溶液的NaOH的浓度。取一定量锥形瓶内混合溶液稀释一定倍数后,加入适量的H2O2溶液后,再滴加2-3滴甲基橙试液,用0.100mol/L盐酸滴定。需要加入H2O2除去ClO-的原因是 。
实验二: 制取水合肼。(实验装置如图所示)

控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114℃馏分(已知:N2H4·H2O易被NaClO氧化,高温易分解)
(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
蒸馏时需要减压,原因是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成1000mL溶液,移出10.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是能与在滴定过程中产生的 反应。
(6)实验测得消耗I2溶液的平均值为16.40mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是 。(填字母)
A.HCHO与水分子间能形成氢键
B.HCHO和CO2分子中的中心原子均采用sp2杂化
C.苯分子中含有6个 键和1个大
键和1个大 键,苯是非极性分子
键,苯是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
| 元 素 |
Mn |
Fe |
|
| 电离能 /kJ·mol-1 |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
Mn元素价电子排布式为 ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(3)铁原子核外有__________种运动状态不同的电子。
(4)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(5)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为 。

(6)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为 。
②与CNO-互为等电子体微粒的化学式为 (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式 。
海水中含有丰富的镁资源。工业上常用海水晒盐后的苦卤水提取Mg,流程如下图所示: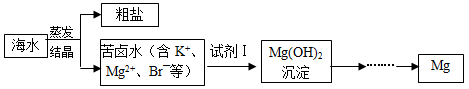
(1)试剂Ⅰ一般选用_________(填化学式)。
(2)工业制取镁的化学方程式为_____________________________________。
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。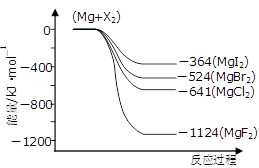
①由图可知Mg与卤素单质的反应均为_________(填“放热”或“吸热”)反应;推测化合物的热稳定性顺序为MgI2 ______MgF2(填“>”、“=”或“<”)。
②依上图数据写出MgBr2(s)与Cl2(g)反应的热化学方程式_________________________。
(4)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体生成。写出CH3MgCl水解的化学方程式______________。
(5)向Mg(OH)2中加入NH4Cl溶液,可使沉淀溶解,请结合平衡原理和必要的文字解释原因_________。
(1)常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=____________。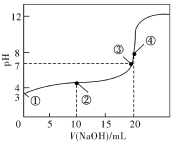
(2)在用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
0.01mol·L-1Na2SO3溶液中通人SO2至溶液呈中性时,溶液中的所有离子的浓度由大到小的顺序是___________________。
(3)向0.1mol·L-1的NaHSO3中通人氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是____________________。
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1molCa(OH)2的澄清石灰水中逐滴加入1mol·L-1的H3PO4,请作出生成沉淀的物质的量随H3PO4滴人体积从0开始至200mL的图像。
根据信息作答:
(1)在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
①写出上述制备小苏打的化学方程式:__________________________________。
②滤出小苏打后,母液提取氯化铵有两种方法:Ⅰ.通入氨,冷却、加食盐,过滤;Ⅱ.不通氨,冷却、加食盐,过滤。其中方法Ⅰ析出的氯化铵的纯度更高,其原因是___________。而方法Ⅱ的优点是其滤液可以_______________。
(2)铅及其化合物可用于蓄电池,耐酸设备及X射线防护材料等。PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为_____________________:PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式_________________,电解液中加入Cu(NO3)2的原因是___________________。
现有铁、碳两种元素组成的合金,某实验小组为了研究该合金的性质并测定该合金中碳的质量分数,设计了如下实验方案和实验装置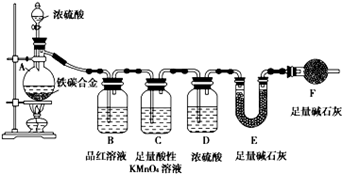
I.探究该合金的某些性质:
(1)取a g合金粉末放人蒸馏烧瓶,并加入足量浓H2SO4,A、B中均无明显现象,原因是_______;
(2)点燃酒精灯一段时间后,A中剧烈反应,请写出此时合金中成分铁的化学反应方程式_____;
(3)反应一段时间后,将C中所吸收的气体通入以下溶液中,判断能否产生沉淀,若不能则写“否”,若能则写出相应的沉淀成分:氯水和氯化钡溶液____,氨水和氯化钡溶液_____;
II.测定样品中碳的质量分数:
(4)装置F的作用__________________________________________________________;
(5)若将SO2气体通入含有n molNa2S的溶液中,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体_____________mol。
某溶液中含K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-中的若干种,某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰。
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成。
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色。下列说法正确的是
| A.原溶液中肯定不含Fe2+、NO3-、SiO32-、I- |
| B.原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- |
| C.步骤Ⅱ中无色气体是NO气体,无CO2气体产生 |
| D.为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
I.有机物A是构成营养素的基础物质,A的球棍模型如图所示,图中“棍” 代表单键或双键或三键,不同颜色的球代表不同元素的原子。回答下列问题:

(1)A的分子式是。官能团的名称是 。
(2)下列有关于A的说法中,正确的是 (选填字母);
A.具有两性
B.能发生消去反应
C.不能发生酯化反应
D.名称为甘氨酸
II. A、B、C三种物质的分子式都是C7H8O,若滴入FeCl3溶液,
只有C呈紫色,且C苯环上的一溴代物有两种结构。若投入金
属钠,只有B没有变化。写出A、B、C的结构简式:A__________,B__________,C__________。
III.有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体。有机物X的仪器分析如下:

①有机物X的红外光谱
有机物X的核磁共振氢谱图峰面积比是1:1:1:1:3,已知X分子中苯环上只有两个相邻的取代基,则X的结构简式是 。
有机物A是常用的食用油抗氧化剂,分子式为C10H12O5,可发生如下转化:

已知B的相对分子质量为60,分子中只含一个甲基。C的结构可表示为

请回答下列问题:
(1)根据系统命名法,B的名称为__________。
(2)官能团—X的名称为____________,高聚物E的链节为________。
(3)A的结构简式为______________。
(4)反应⑤的化学方程式为________________________________________________。
(5)C有多种同分异构体,写出其中2种符合下列要求的同分异构体的结构简式_______________。
Ⅰ.含有苯环 Ⅱ.能发生银镜反应 Ⅲ.不能发生水解反应
(6)从分子结构上看,A具有抗氧化作用的主要原因是_________________(填序号)。
a.含有苯环 b.含有羰基 c.含有酚羟基