根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是
_____________________________________。
(2)下图是SO2生成SO3反应过程中能量变化的曲线图。该反应的热化学方程式为: 。

异丙苯( )氧化法是工业生产苯酚和丙酮最主要的方法。其反应和流程如下:
)氧化法是工业生产苯酚和丙酮最主要的方法。其反应和流程如下:
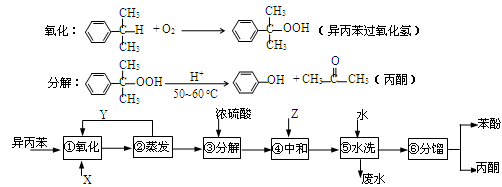
已知:
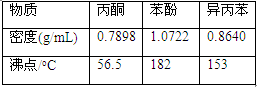
完成下列填空:
(1).X物质是 ;Y物质是 。
(2).浓硫酸的作用是 ,其优点是用量少,可能的缺点是 (写一条)。
(3).Z物质最适宜选择 (选填编号)。
a.NaOH b.Na2CO3 c.NaHCO3 d.CaCO3
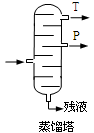
(4).步骤⑥分馏,工业上在分馏塔中进行,如右图,产品T是 ,请说明理由 。
废水中苯酚的含量,可根据苯酚与溴水的反应,用以下方法测定:
①把20.00mL废水、20mLKBrO3和KBr混合溶液[其中:
c(KBrO3)=0.0100mol/L,c(KBr)=0.0600mol/L]置于锥形瓶中,再加入10mL6mol/L的盐酸,迅速盖好盖子,摇动锥形瓶。
②充分反应后,稍松开瓶塞,从瓶塞和瓶壁间缝隙迅速加入10%KI溶液10mL(过量),迅速加盖,充分摇匀。加入少许淀粉溶液。
③用0.0250 mol/LNa2S2O3标准溶液滴定至终点。用去Na2S2O3溶液22.48mL。
(5).已知:BrO3–+5Br–+6H+→3Br2 + 3H2O ;写出苯酚与浓溴水反应的化学方程式 ;
第①步加盐酸、第②步加KI溶液,要迅速盖好盖子的原因是 。
(6).已知:I2 + 2Na2S2O3→2NaI + Na2S4O6;滴定终点的现象是 ;该废水中苯酚的浓度是 mol/L(保留4位小数)。
实验小组为探究SO2的漂白性和还原性,设计了以下实验。
完成下列填空:
(1).实验室用亚硫酸钠粉末跟硫酸制取二氧化硫,有下列三种硫酸溶液,应选用 (选填编号),其理由是 。
a.98%浓硫酸 b.70%硫酸 c.10%稀硫酸
І.漂白性
(2).用如图所示装置(气密性良好)进行实 验,观察到如下现象:ⅰ中红色褪去、

ⅱ中无变化。
①足量碱石灰的作用是 。
②从实验中可知使品红的水溶液褪色的 微粒可能是 。
(3).实验小组进一步实验如下:取等量相同浓度
的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,于是得出结论:使品红褪色的微粒肯定是HSO3–或SO32–。你认为这一结论是否正确 ,理由是 。
ІІ.还原性
(4).将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是 ,如何检验该反应所得含氧酸根离子 。
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。
已知:红棕色为FeSO3(墨绿色难溶物)与FeCl3溶液形成的混合色;Fe3+可氧化SO32–。
则②中红棕色变为浅绿色的原因是 。
氯气用途广泛,但在使用时,一般会产生氯化氢。工业上可用O2将HCl转化为Cl2,以提高效益,减少污染。反应为:
完成下列填空:
(1).该反应化学平衡常数K的表达式为 ;
实验测得P0压强下,HCl平衡转化率α(HCl)随反应温度T的变化如图所示,则正反应是 反应(填“吸热”或者“放热”)。
(2).上述实验中若压缩体积使压强由P0增大至P1,在图中画出P1压强下HCl平衡转化率α(HCl)随反应温度T变化的曲线,并简要说明理由: 。
(3).该反应在P0、320°C条件下进行,达平衡状态A时,测得容器内n(Cl2)=7.2×10–3mol,则此时容器中的n(HCl)= mol。
(4).对该反应达到平衡后,以下分析正确的是 (选填编号)。
a.增加n(HCl),对正反应的反应速率影响更大
b.体积不变加入稀有气体,对正反应的反应速率影响更大
c.压强不变加入稀有气体,对逆反应的反应速率影响更大
d.如果平衡常数K值增大,对逆反应的速率影响更大
(5).氯元素能形成多种离子。在水溶液中1molCl–、1mol ClOx–(x=1,2,3,4)能量的相对大小如图所示,写出B→A+C反应的热化学方程式(用离子符号表示) ;若有1.5molB发生反应,转移电子 mol。

某温度(T℃)下的溶液中,c(H+)=10﹣x mol·L﹣1,c(OH﹣)=10﹣y mol·L﹣1,x与y的关系如图所示,请回答下列问题:
(1)此温度下,水的离子积Kw为 ,则该温度T 25(填“>”、“<”或“=”).
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示.
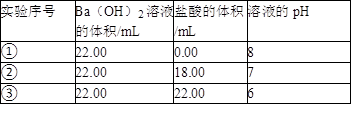
假设溶液混合前后的体积变化忽略不计,则a= ,实验②中由水电离产生的c(OH﹣)= mol·L﹣1.
(3)在此温度下,将0.1mol·L﹣1的NaHSO4溶液与0.1mol·L﹣1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
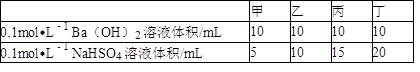
①按丁方式混合后,所得溶液显 (填“酸”、“碱”或“中”)性.
②写出按乙方式混合后,反应的离子方程式: .
③按甲方式混合后,所得溶液的pH为 .
氢能的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态的电子排布式可表示为 。
②B的空间构型是 (用文字描述)。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是 。
2NH3实现储氢和输氢。下列说法正确的是 。
a.NH3分子中N原子采用sp3杂化
b.相同压强时,NH3沸点比PH3高
c.[Cu(NH3)4]2+中,N原子是配位原子
d.CN-的电子式为[∶C︙︙N∶]-
(3)2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子。
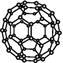
C60分子结构
①C60晶体易溶于苯、CS2,说明C60是 分子(选填“极性”或“非极性”)。
②1 mol C60分子中,含有σ键数目为 。
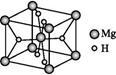
(4)MgH2是金属氢化物储氢材料,其晶胞结构如图所示,已知该晶体的密度为a g·cm-3,则晶胞的体积为 cm3[用a、NA表示(NA表示阿伏加德罗常数的数值)]。
(1)某同学以H2O2分解为例,探究浓度与溶液酸碱性对反应速率的影响。常温下,按照如表所示的方案完成实验。
| 实验编号 |
反应物 |
催化剂 |
|
| a |
50 mL 5% H2O2溶液 |
|
1 mL 0.1 mol· L-1 FeCl3溶液 |
| b |
50 mL 5% H2O2溶液 |
少量浓盐酸 |
1 mL 0.1 mol· L-1 FeCl3溶液 |
| c |
50 mL 5% H2O2溶液 |
少量浓 NaOH溶液 |
1 mL 0.1 mol· L-1 FeCl3溶液 |
| d |
50 mL 5% H2O2溶液 |
|
MnO2 |
①测得实验a、b、c中生成氧气的体积随时间变化的关系如图1所示。

由该图能够得出的实验结论是__________________________。
②测得实验d在标准状况下放出氧气的体积随时间变化的关系如图2所示。解释反应速率变化的原因:_______________________________。
(2)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g) TaI4(g)+S2(g) ΔH>0 ,
TaI4(g)+S2(g) ΔH>0 ,
①反应的平衡常数表达式K=________ ,若K=1,向某恒容密闭容器中加入1 mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为________。

图3
②如图3所示,上面反应在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1________T2(填“>”“<”或“=”)。上述反应体系中循环使用的物质是________。
已知反应:2CH3COCH3(l) CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如下图所示。下列说法正确的是( )
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0 ℃和20 ℃下,测得其转化分数随时间变化的关系曲线(Y-t)如下图所示。下列说法正确的是( )
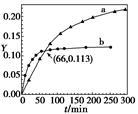
| A.b代表0 ℃下CH3COCH3的Y-t曲线 |
B.反应进行到20 min 末,CH3COCH3的 >1 >1 |
| C.升高温度可缩短反应达平衡的时间并能提高平衡转化率 |
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的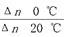 =1 =1 |
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。

(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_______________________。
(2)Ⅱ中,2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
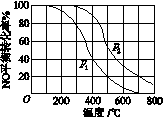
①比较p1、p2的大小关系: 。
②随温度升高,该反应平衡常数变化的趋势是 。
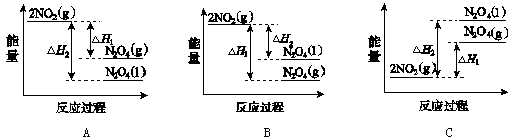
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g) N2O4(g)ΔH1 2NO2(g)
N2O4(g)ΔH1 2NO2(g) N2O4(l)ΔH2
N2O4(l)ΔH2
下列能量变化示意图中,正确的是 (选填字母)。
②N2O4与O2、H2O化合的化学方程式是 。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。
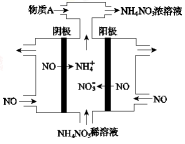
为使电解产物全部转化为NH4NO3,需补充A。A是 ,说明理由: 。
某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
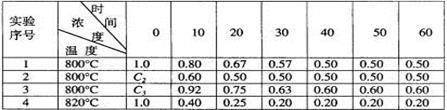
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为______________mol/(L·min)。
(2)在实验2,A的初始浓度C2=________mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)实验3的反应速率为V3,实验1的反应速率为V1,则V3 V1,且C3 1.0mol/L(填>、=、<)。
(4)比较实验4和实验1,可推测该反应是_________反应(选填吸热、放热)。理由_____________。
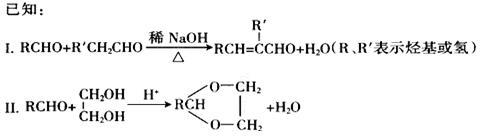
合成具有良好生物降解性的有机高分子材料是有机化学研究的重要课题之一。聚醋酸乙烯酯(PVAc)水解生成的聚乙烯醇(PVA),具有良好生物降解性,常用于生产安全玻璃夹层材料PVB。有关合成路线如下图(部分反应条件和产物略去)。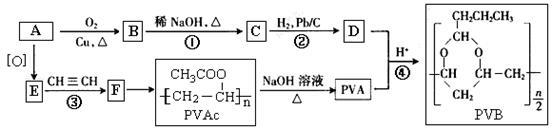
请回答:
(1)A为饱和一元醇,其氧的质量分数约为34.8%,A的化学名称为_____________,PVA的结构简式为_________________。
(2)C中官能团的名称是____________,C的名称_________________,A~F中核磁共振氢谱出峰最多的是________________(填化合物代号)。
(3)反应①包含的反应类型是_________________;反应④的化学方程式为_________。
(4)PVAc是由F加聚而成,与F具有相同官能团的同分异构体还有_______种;写出其中一种的结构简式:________________。
有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为: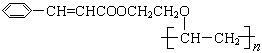 。按下图可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。
。按下图可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。
已知:①
②
回答下列问题:
(1)试剂Ⅰ的名称是_________;B→C的反应类型是____________。
(2)质谱图显示A的相对分子质量是80.5;A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2∶2∶1,则A的结构简式为_______________。
(3)写出下列反应的化学方程式。
①D→E的反应 __________________________。
②C与F的反应 _________________________。
(4)E的一种同分异构体,水解产物有两种,一种能使溴水褪色,另一种在滴加到饱和溴水中后,有白色沉淀生成,该物质的结构简式为 _________________。
已知苯甲醛在一定条件下可以通过Perkin反应生成肉桂酸(产率45%~50%),另一个产物A也呈酸性,反应方程式如下:

(1)Perkin反应合成肉桂酸的反应式中,反应物的物质的量之比为1:1,产物A的名称是 。
(2)一定条件下,肉桂酸与乙醇反应生成香料肉桂酸乙酯,其反应方程式为 。
(3)取代苯甲醛也能发生Perkin反应,相应产物的产率如下:
| 取代苯甲醛 |
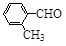 |
 |
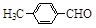 |
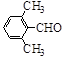 |
| 产率(%) |
15 |
23 |
33 |
0 |
| 取代苯甲醛 |
 |
 |
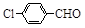 |
 |
| 产率(%) |
71 |
63 |
52 |
82 |
可见,取代基对Perkin反应的影响有(写出3条即可):
①________________________________
②___________________ _
③________________________________
(4)溴苯(C6H5Br)与丙烯酸乙酯(CH2=CHCOOC2H5)在氯化钯(PbCl2)催化下可直接合成肉桂酸乙酯,该反应属于Beck反应,是芳香环上的一种取代反应,其反应方程式为 。
(5)Beck反应中的有机产物不能发生的反应是__________(填字母)。
(A)加成反应 (B)取代反应 (C)氧化反应 (D)消去反应
有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为: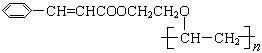 。按下图可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。
。按下图可以合成甲,其中试剂Ⅰ可由相对分子质量为26的烃与水加成制得。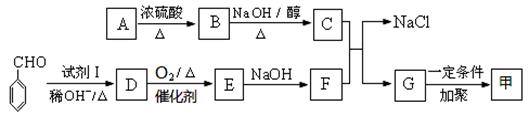
已知:①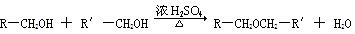
②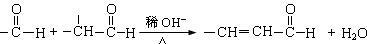
回答下列问题:
(1)试剂Ⅰ的名称是_________;B→C的反应类型是____________。
(2)质谱图显示A的相对分子质量是80.5;A分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A的核磁共振氢谱上有三个吸收峰,峰面积的比例为2∶2∶1,则A的结构简式为_______________。
(3)写出下列反应的化学方程式。
①D→E的反应 __________________________。
②C与F的反应 _________________________。
(4)E的一种同分异构体,水解产物有两种,一种能使溴水褪色,另一种在滴加到饱和溴水中后,有白色沉淀生成,该物质的结构简式为 _________________。