将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液含有大量的阳离子是( )
| A.Cu2+和Fe2+ | B.H+和Cu2+ |
| C.Fe2+和Mg2+ | D.Fe3+和Fe2+ |
在无色强酸性溶液中,下列各组离子能够大量共存的是( )
| A.K+、Ba2+、Cl-、SO42- | B.NH4+、HCO3-、Cl-、K+ |
| C.Cl-、Na+、NO3-、Ca2+ | D.Fe2+、NO3-、I-、Cl- |
下列溶液中,Na+浓度最大的是( )
| A.0.5mol/LNaCl溶液 | B.1L3mol/LNa2SO4溶液 |
| C.0.4mol/LNaOH溶液 | D.2L0.15mol/LNa3PO4溶液 |
区别NaCl、FeCl3和NH4Cl三种溶液,可选用下列试剂中的( )
| A.KSCN溶液 | B.NaOH溶液 | C.AgNO3溶液 | D.BaCl2溶液 |
有关Na2CO3和NaHCO3的叙述中正确的是( )
| A.NaHCO3比Na2CO3热稳定性强 |
| B.Na2CO3和NaHCO3均可与澄清石灰水反应 |
| C.Na2CO3和NaHCO3均可与NaOH反应 |
| D.相同质量的Na2CO3和NaHCO3分别与足量稀盐酸作用时,产生的气体质量相同 |
关于合金的叙述,不正确的是( )
| A.合金的熔沸点比原任一金属要高 |
| B.合金的硬度比原任一金属要大 |
| C.非金属也可以是合金的成分之一 |
| D.合金的用途比纯金属的用途更广 |
下列溶液中能够区别SO2和CO2气体的是( )
①澄清石灰水 ②H2S溶液 ③KMnO4溶液 ④品红溶液
| A.①②③ | B.①③④ | C.②③④ | D.①②③④ |
现有三组溶液:①汽油和氯化钠溶液 ②49%的乙醇溶液 ③氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
| A.分液、蒸馏、萃取 | B.萃取、蒸发、分液 |
| C.分液、萃取、蒸馏 | D.蒸馏、萃取、分液 |
等物质的量的氢气和氨气在同温同压下具有相等的( )
| A.原子数 | B.体积 | C.质子数 | D.质量 |
食盐、食醋、纯碱等都是厨房常用的物质,其中属于盐的是( )
| A.食盐和食醋 | B.食盐和纯碱 | C.纯碱和食醋 | D.全部 |
下列气体不会造成大气污染的是( )
| A.SO2 | B.CO | C.N2 | D.NO |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+和K+。取该溶液100mL,加入过量NaOH溶液并加热,得到0.02mol气体,同时产生红褐色沉淀,将过滤洗涤后的沉淀灼烧得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。下列说法正确的是
| A.该溶液中最多存在4种离子 |
| B.该溶液中不能确定是否存在CO32- |
| C.该溶液中一定存在Cl-、且c(Cl-)≥0.4mol∙L-1 |
| D.该溶液可由KCl、(NH4)2SO4和FeCl3配制而成 |
NA为阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA |
| B.1L0.1mol∙L-1氨水中NH3∙H2O分子数为0.1NA |
| C.标准状况下,1.12LCl2发生反应转移的电子数一定为0.1NA |
| D.10g46%酒精(C2H5OH)中含氧原子总数为0.1NA |
下列离子能满足相应要求的是
| 选项 |
离子组 |
要求 |
| A |
K+、CO32-、SO42-、Cl- |
c(K+)<c(Cl-) |
| B |
Na+、CO32-、NO3-、I- |
滴加盐酸立刻有气体生成 |
| C |
Mg2+、Cl-、Na+、SO42- |
滴加氨水立刻有沉淀生成 |
| D |
NH4+、SO42-、Na+、H+ |
滴加烧碱溶液立刻有气体生成 |
中学化学常见物质A、B、C、D、X、Y,存在如下图转化关系(部分物质和条件略去)
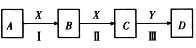
(1)若A为NaOH溶液,X为CO2,D是沉淀,则Y可为___________(填序号)。
A.SO3 B.Ba(OH)2 C.H2SO4 D.CaO
(2)若A为黄铁矿(FeS2),D是H2SO4,则反应Ⅱ的化学方程式为_________________________。
(3)若A为碱性气体,A与D反应生成一种化肥,则反应Ⅲ的化学方程式为__________________。
(4)若A和X均为单质,反应Ⅲ的现象是白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色,则反应II的离子方程式为__________________________。