下列事实中,与电化学腐蚀和防护无关的是
A 大型水闸常与直流电源的负极相连,再在电极的正极连上惰性电极,置于水中
B 在电线的外面常包裹一层塑料
C 埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
D 减少钢铁中的含碳量,可以增强钢铁的耐腐蚀能力
下列说法正确的是( )
| A.当∆H﹤0时,表示该反应为吸热反应 |
B.相同条件下,溶液中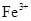 、 、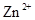 、 、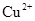 的氧化性依次减弱 的氧化性依次减弱 |
| C.铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| D.钢铁吸氧腐蚀的正极电极反应:O2+2H2O+4e-==4OH- |
下列说法正确的是( )
| A.同温同压下,H2 + Cl2 = 2HCl在光照和点燃条件的△H不同 |
| B.粗铜精炼时,与电源负极相连的是粗铜 |
| C.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
| D.天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源 |
如图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入一生铁块,放置一段时间。下列有关描述错误的是


A.生铁块中的碳是原电池的正极 |
B.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀 |
C.两试管中相同的电极反应式是:Fe-2e-= Fe2+ |
D.红墨水柱两边的液面变为左低右高 |
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴下氧气含量比边缘少。下列说法正确的是
| A.液滴中的Cl―由a区向b区迁移 |
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e- 4OH- 4OH- |
| C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈 |
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e- Cu2 Cu2 |
钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O=2Fe(OH)2;②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
③2Fe(OH)3=Fe2O3+3H2O。下列说法正确的是
| A.金属的化学腐蚀比电化学腐蚀更普遍 |
| B.反应①中氧化剂是氧气和水 |
| C.与铜质水龙头连接处的钢质水管不易发生腐蚀 |
| D.反应①、②中电子转移数目相等 |
利用如图装置探究铁在海水中的电化学腐蚀与防护。下列说法不正确的是
| A.若X为锌棒,开关K置于M处,可减缓铁的腐蚀,采用了牺牲阳极的阴极保护法 |
| B.若X为锌棒,开关K置于N处,X极的反应:4OH--4e-=O2↑+2H2O |
| C.若X为碳棒,开关K置于N处,可减缓铁的腐蚀,采用了外加电流的阴极保护法 |
| D.若X为碳棒,开关K置于M处,X极的反应:O2+4e-+2H2O=4OH- |
下列有关钢铁腐蚀与防护的说法正确的是( )
| A.钢管与电源正极连接,钢管可被保护 |
| B.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 |
| C.钢管与铜管露天堆放在一起时,钢管不易被腐蚀 |
| D.钢铁发生析氢腐蚀时,负极反应是Fe-3e-=Fe3+ |
钢铁生锈过程发生如下反应:
①2Fe+O2+2H2O==2Fe(OH)2
②4Fe(OH)2+O2+2H2O==4Fe(OH)3
③2Fe(OH)3====Fe2O3+3H2O
下列说法正确的是
| A.反应①、②中电子转移数目相等 | B.反应①中氧化剂是氧气和水 |
| C.三个反应都是氧化还原反应 | D.钢铁在潮湿的空气中不能发生电化学腐蚀 |
下列说法正确的是
| A.金属腐蚀就是金属原子失去电子被还原的过程 |
| B.钢铁吸氧腐蚀时,负极反应式为2H2O+O2+4e-===4OH- |
| C.氯碱工业中,阳极发生的反应为2Cl--2e-===Cl2↑ |
| D.工业上电解精炼铜时,阳极减小的质量和阴极增加的质量相等 |
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是
| A.镀锌层破损后即对铁制品失去保护作用 |
| B.未通电前上述电镀装置可构成原电池,电镀过程是该原电池的充电过程 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为:2Fe+2H2O+O2 2Fe(OH)2。以下说法正确的是( )
| A.负极发生的反应为:Fe-2e- |
| B.正极O2被氧化发生氧化反应 |
| C.原电池是将电能转变为化学能的装置 |
| D.钢柱在水下部分比在空气与水交界处更容易腐蚀 |