下列物质的说法正确的是
| A.芳香烃可以来自于煤干馏产品中的煤焦油 |
| B.聚氯乙烯可用于制作食品包装袋 |
| C.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀 |
| D.在铁的吸氧腐蚀中,负极是炭,电极反应为2H2O+O2+4eˉ=" 4OHˉ" |
结合下图判断,下列叙述正确的是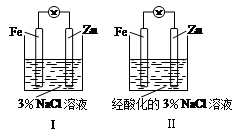
| A.Ⅰ和Ⅱ中正极均被保护 |
| B.Ⅰ和Ⅱ中负极反应均是:Fe-2e-===Fe2+ |
| C.Ⅰ正极反应是:O2 + 2H2O + 4e-===4OH- |
| D.Ⅰ和Ⅱ中分别加入少量KSCN溶液,溶液均变红 |
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.枪炮表面涂上一层油 | D.地下钢管连接镁块 |
为探究钢铁的吸氧腐蚀原理设计了如图所示装置,下列有关说法中错误的是 
| A.正极的电极方程式为:O2+2H2O+4e-===4OH- |
| B.将石墨电极改成Mg电极,难以观察到铁锈生成 |
| C.若向自来水中加入少量NaCl(s),可较快地看到铁锈 |
| D.向铁电极附近吹入O2比向石墨电极附近吹入O2,铁锈出现得快 |
下列叙述错误的是( )
| A.废弃的干电池不能随意丢弃,但可以土埋处理 |
| B.马口铁(镀锡铁)镀层破损后即失去保护作用 |
| C.不能将铁制自来水管与铜制水龙头连接使用 |
| D.电化学腐蚀过程中存在电极反应,产生微电流 |
下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
| A.用氧化剂使金属表面生成致密稳定的氧化物保护膜 |
| B.在金属中加入一些铬或镍制成合金 |
| C.在轮船的壳体水线以下部分装上锌锭 |
| D.金属表面喷漆 |
钢铁发生吸氧腐蚀时,正极发生反应的电极反应式为
| A.Fe-2e-=Fe2+ | B.Fe-3e-=Fe3+ | C.O2+2H2O+4e-=4OH- | D.2H++2e-= H2 ↑ |
某研究小组对铁生锈进行研究:
(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是 (填字母)。
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为: ;
(3)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是( )
A. 锡 B. 铜 C. 锌
(4)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下: 
为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
下列有关金属铁的腐蚀与防护,说法正确的是
| A.酸雨后易发生析氢腐蚀、炒锅存留盐液时易发生吸氧腐蚀 |
| B.当镀锡铁和镀锌铁镀层破损时,后者更易被腐蚀 |
| C.铁与电源正极连接可实现电化学保护 |
| D.将钢管与铜管一起堆放时可保护钢管少受腐蚀 |
下图的各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是
| A.⑷>⑵>⑴>⑶ | B.⑵>⑴>⑶>⑷ |
| C.⑷>⑵>⑶>⑴ | D.⑶>⑵>⑷>⑴ |
(1)若用食用油炒咸菜的铁锅如果没有洗净,不久会出现红褐色锈斑。则铁锅的锈蚀属于 腐蚀(填“析氢”或“吸氧”);该腐蚀正极的电极反应式为 ;此反应每转移2mol电子消耗的O2在标准状况下的体积为 L。
(2)某同学用碳棒、铜棒和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下边方框中画出能够实验这一反应的装置图(作必要的标注);某同学做该实验时,看到
碳棒上有气泡产生,铜棒上气泡更多且没有被腐蚀,其原因是 。
下列事实与电化学腐蚀无关的是
| A.生铁比纯铁易生锈 |
| B.黄铜(铜锌合金)制品不易产生铜绿 |
| C.纯银饰品久置表面变暗 |
| D.与铜管连接的铁管易生锈 |
下列有关电化学原理的说法错误的是( )
| A.氯化铝的熔点比氧化铝低,因此工业上最好采用电解熔融氯化铝来制备单质铝 |
| B.电镀时,通常把待镀的金属制品作阴极,把镀层金属作阳极 |
| C.对于冶炼像钠、钙、镁、铝等这样活泼的金属,电解法几乎是唯一可行的工业方法 |
| D.对大型船舶的外壳进行的“牺牲阳极的阴极保护法”,是应用了原电池原理 |