如图为甲和乙两种固体物质的溶解度曲线。回答下列问题:
(1)当温度为 时,甲、乙两种物质的饱和溶液中溶质的质量分数相等。
(2)图中a点对应的甲溶液是 (填"饱和"或"不饱和")溶液。
(3)当温度为t 3℃时,要将质量分数为20%的甲溶液100g变成饱和溶液,需要加入 g甲固体(不含结晶水)。

如图是A、B、C三种物质的溶解度曲线,请认真分析并回答:
(1)t3℃时,A、B、C三种物质的溶解度由小到大的顺序为 。
(2)t2℃时,A、B、C三种物质的饱和溶液降温到t1℃时变为不饱和溶液的是 。
(3)当A中含有少量的B,可采用 (填“降温”或“蒸发”)结晶的方法提纯A物质。
(4)t3℃时,若用A、B两物质各50g配成饱和溶液,则所需加水的质量A B(填“>”,“<”,“=”号)

如图是a、b、c三种固体物质的溶解度曲线图,请回答问题:
(1)t1℃时,a、b、c三种物质中,溶解度由大到小的顺序是 。
(2)将c物质的不饱和溶液转变成饱和溶液可采取的方法有 (写出一种即可)。
(3)t2℃时,将30ga物质加入50g水中充分溶解后,所得溶液的质量是 g。
(4)图中P点所表示的意义是 。

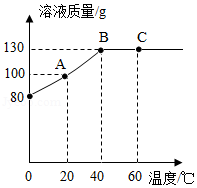
将80gM物质加入50g水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示,按要求填空。
(1)A点时,该溶液的溶质质量分数为 。
(2)A、B、C三点所对应的溶液,属于不饱和溶液的是 (填字母)。
(3)在40℃时,M物质的溶解度为 g,若保持溶剂的质量不变,从C点对应的溶液获得M的晶体,可以采用的方法是 。
根据A、B、C三种物质的溶解度曲线图回答下列问题:
(1)t3℃时,A、B、C三种物质的溶解度由大到小顺序是 ;
(2)图中P点的含义是 ;
(3)t3℃时向盛有50g A物质的烧杯里加入50g水,充分溶解后,所得溶液的质量为 g;
(4)A、B、C三种物质的饱和溶液从t1℃升温到t2℃,溶质质量分数由小到大的顺序是 ;
(5)若A物质中混有少量的C物质,最好采用 的方法提纯A;
(6)要使接近饱和的A、B、C三种溶液都变为饱和溶液,可同时采用的方法是 (任填一种)。

图一是甲、乙两种固体物质的溶解度曲线,分析并回答问题。

(1)P点的含义是 。
(2)t2℃时,将甲、乙各30g分别加入到盛有50g水的两个烧杯中,充分溶解后,现象如图二所示。
①B烧杯中溶液的溶质是 (填“甲”或“乙”)。
②将B烧杯中的溶液全部倒入A烧杯中(甲和乙不反应),充分搅拌后,A烧杯中的固体 (填“全部溶解”“部分溶解”或“不溶解”)。
③欲使混合溶液恰好形成甲的饱和溶液,应再加入甲 g。
潍坊有丰富的海洋资源,氯化钠占整个海洋盐类的80%以上.下列有关氯化钠的说法正确的是( )
A.室温下的氯化钠饱和溶液不能再溶解氯化钾
B.取出部分上层溶液,可将接近饱和的氯化钠溶液变为饱和
C.可用硝酸银溶液鉴别氯化钠和氯化镁溶液
D.将100g质量分数为20%的氯化钠溶液稀释为10%,所用的仪器有:烧杯、量筒、玻璃棒和胶头滴管
我市东临渤海,有着丰富的海洋资源,请思考下列问题
(1)已知东营盐场测得:①海水中含NaCl约为3.5%;②在海边打深井,井水中含NaCl约为8%.晒盐最好用 (填序号)作原料。
(2)关于晒盐原理的说法正确的是 。
A、利用阳光和风力,使水分蒸发,析出盐
B、日光照晒后,氯化钠的溶解度变小
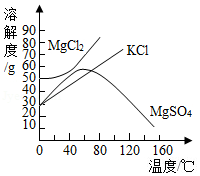
(3)海水晒盐提取食盐晶体后留下的母液叫卤水,其中含有的KCl、MgCl2、MgSO4等物质可作为重要的化工原料,它们的溶解度曲线如图所示。
①60℃时,将50g;硫酸镁加入到100g水中,充分搅拌,所得溶液的溶质质量分数为 ,若使其形成饱和溶液,可采取的措施有 。
A、增加溶质 B、蒸发溶剂 C、升高温度 D、降低温度
②对卤水中含有的KCl、MgCl2、MgSO4三种物质,下列说法正确的是 。
A、三种物质均为易溶物质
B、20℃时,向40gKCl固体和40gMgCl2固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态。
C、60℃时,三种物质溶于水形成的溶液浓度可能相等。
下列图象不能正确反映对应变化关系的是( )
A. 向盛有NaOH溶液的烧杯中滴加稀盐酸
向盛有NaOH溶液的烧杯中滴加稀盐酸
B. 加热氯酸钾和二氧化锰的固体混合物
加热氯酸钾和二氧化锰的固体混合物
C. 在一定温度下,向接近饱和的氯化钾溶液中加入氯化钾固体
在一定温度下,向接近饱和的氯化钾溶液中加入氯化钾固体
D. 将质量相等的镁粉和锌粉分别加入到足量且质量分数相等的稀硫酸中
将质量相等的镁粉和锌粉分别加入到足量且质量分数相等的稀硫酸中
下列有关溶液的叙述正确的是( )
| A. |
凡是均一稳定的液体一定是溶液 |
B. |
不饱和溶液一定是稀溶液 |
| C. |
增加溶质可使不饱和溶液变成饱和溶液 |
D. |
可溶性物质溶于水时一定会放出热量 |
根据如表回答问题。
| 温度(℃) |
20 |
40 |
50 |
60 |
80 |
|
| 溶解度(g/100g水) |
NaCl |
36.0 |
36.6 |
37.0 |
37.3 |
38.4 |
| NH 4Cl |
37.2 |
45.8 |
50.4 |
55.2 |
65.6 |
|
| KNO 3 |
31.6 |
63.9 |
85.5 |
110 |
169 |
①20℃时,溶解度最大的物质是
②50℃时,100g水中最多溶解NaCl g
③量筒的局部示意见图,量取水时应沿 视线(选填"a"或"b")进行读数, 视线(选填"a"或"b")对应的读数较大。
④A是80℃含有120g水的KNO 3溶液,经过如下操作,得到102gKNO 3固体。

Ⅰ.A溶液为 (选填"饱和"或"不饱和")溶液
Ⅱ.对以上过程的分析,正确的是 (选填编号)
a.A到B的过程中,溶质质量没有改变
b.B中溶质与溶剂的质量比为169:100
c.开始析出KNO 3固体的温度在60℃至80℃之间
d.A溶液的质量等于222g。

如表给出了氯化钠和碳酸钠在不同温度时的溶解度,根据此表推断合理的是( )
| 温度/℃ |
10 |
20 |
30 |
40 |
|
| 溶解度/g |
氯化钠 |
35.8 |
36.0 |
36.3 |
36.6 |
| 碳酸钠 |
12.2 |
21.8 |
39.7 |
49.6 |
|
| A. |
20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到不饱和溶液 |
| B. |
20℃时,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为30% |
| C. |
两物质的溶解度曲线在20℃﹣30℃之间应出现交点 |
| D. |
可以采用降温结晶的方法从二者的混合物中提纯氯化钠 |
溶液是一种重要的混合物,下列有关溶液的说法正确的是( )
| A. |
溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止不动 |
| B. |
饱和溶液是一定温度下不能再溶解该物质的溶液 |
| C. |
不饱和溶液通过降低温度一定能变成饱和溶液 |
| D. |
一种物质分散到另一种物质里一定能形成溶液 |
下列表格为氯化钠和硝酸钾在不同温度时的溶解度。结合表中数据回答:
温度/℃ |
0 |
20 |
40 |
60 |
溶解度/g |
||||
氯化钠 |
35.7 |
36.0 |
36.6 |
37.3 |
硝酸钾 |
13.3 |
31.6 |
63.9 |
110 |
(1)在40℃时,硝酸钾的溶解度是 g。
(2)要使一定质量接近饱和的硝酸钾溶液变为饱和溶液,可以采用的方法是 。(写出一种)
(3)在20℃时,将24g氯化钠固体投入到50g水中,充分溶解后,所得溶液中溶质的质量分数是 。