化学反应原理是中学化学学习的重要内容。请回答下列问题:
(1)下列判断正确的是______________。
①CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH1 CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH2
则ΔH1﹤ΔH2
②H2(g)+ O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
O2(g)===H2O(l) ΔH1 2H2(g)+O2(g)═2H2O(l) ΔH2
则ΔH1﹤ΔH2
③t ℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时反应放出的热量分别为Q1和Q2
则Q1﹤Q2
④CaCO3(s)===CaO(s)+CO2(g)ΔH1 CaO(s)+H2O(l)===Ca(OH)2(s)ΔH2
则ΔH1﹤ΔH2
(2)依据氧化还原反应Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)
设计的原电池如图所示。

请回答下列问题:
①铜电极发生的电极反应为_____________________。
②溶液中Cu2+向________极移动。
(3)在一恒温、恒容密闭容器中充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g) + 3H2(g)  CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
CH3OH (g) + H2O(g) △H=-49.0 kJ/mol
某种反应物和生成物的浓度随时间变化如图所示。

回答下列问题:
①Y的化学式是 。
②反应进行到3min时, v正 v逆(填“>”或“<”、“=”)。反应前3min,H2的平均反应速率,v(H2)= mol·L-1·min-1。
③能证明该反应达到化学平衡状态的依据是 。
| A.容器内各气体的体积分数保持不变 |
| B.混合气体密度不变 |
| C.3v逆(CH3OH) =v正(H2) |
| D.混合气体的平均相对分子质量不变 |
E.CO2的转化率为70%
F.混合气体中CO2与H2的体积比为1﹕3
④上述温度下,反应CH3OH (g) + H2O(g)  CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
CO2(g) + 3H2(g)的平衡常数K= (计算结果保留2位小数)。
⑤上述反应达到平衡后,往容器中同时加入0.1mol CO2和0.3mol H2O (g),此时平衡将 (填“向左”、“向右”或“不”)移动。
(4)室温时,向20 mL 0.1 mol/L的醋酸溶液中不断滴入0.1 mol/L的NaOH溶液,溶液的pH变化与所加NaOH溶液体积的关系如下图所示。下列有关溶液中离子、分子浓度大小关系的描述中正确的是____________。

①.a点时:c(CH3COOH) >c(CH3COO-) > c(Na+) > c(H+) >c(OH-)
②.b点时:c(Na+)=c(CH3COO-) >c(H+) =c(OH-)
③.c点时:c(OH-)=c(CH3COOH)+c(H+)
④.d点时:c(Na+)> c(CH3COO-) > c(OH-) >c(H+)
 2C(g) +2D(g),2 min 末反应达到平衡状态,生成0.8 mol D,请填写下面空白:
2C(g) +2D(g),2 min 末反应达到平衡状态,生成0.8 mol D,请填写下面空白: 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下: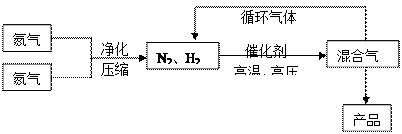
 95.79
95.79 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
 Fe(s)+ CO2(g)△H>0
Fe(s)+ CO2(g)△H>0 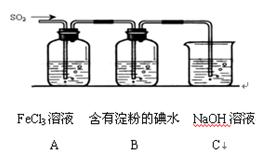
 入新制的氯水,溶液变红
入新制的氯水,溶液变红
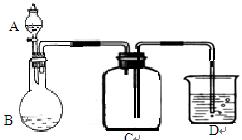
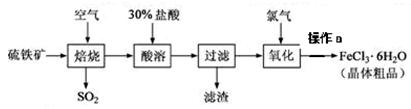
 2SO3,该反应的平衡常数表达式为K=;过量的SO2与NaOH溶液反应的化学方程式为。
2SO3,该反应的平衡常数表达式为K=;过量的SO2与NaOH溶液反应的化学方程式为。 溶液吸收,尾气中污染空气的气体为(写化学式)。
溶液吸收,尾气中污染空气的气体为(写化学式)。 粤公网安备 44130202000953号
粤公网安备 44130202000953号