以下甲、乙、丙为探究原电池原理的有关装置,试回答下列问题: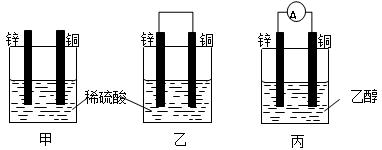
(1)甲中预计可以观察到得现象是:铜片上 (填“有”或“没有”)气泡产生,锌片上 (填“有”或“没有”)气泡产生。
(2)乙中锌为原电池的 极,电极反应是 ;铜为原电池的 极,电极反应是 。原电池总反应为
(3)丙中电流计A的指针是否发生偏转: (填“是”或“否”)
以下甲、乙、丙为探究原电池原理的有关装置,试回答下列问题:
(1)甲中预计可以观察到得现象是:铜片上 (填“有”或“没有”)气泡产生,锌片上 (填“有”或“没有”)气泡产生。
(2)乙中锌为原电池的 极,电极反应是 ;铜为原电池的 极,电极反应是 。原电池总反应为
(3)丙中电流计A的指针是否发生偏转: (填“是”或“否”)