某溶液含有Ba2+、 Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下(写出最佳答案):
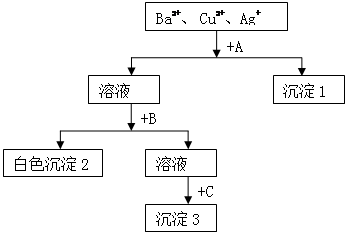
(1)所加试剂的化学式:A_________ 、C_________ _
(2)生成沉淀3的离子方程式_________________________ ____
某溶液含有Ba2+、 Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下(写出最佳答案):

(1)所加试剂的化学式:A_________ 、C_________ _
(2)生成沉淀3的离子方程式_________________________ ____