在0.24 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。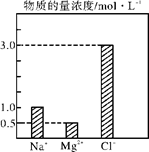
(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1200mL,稀释后溶液中Ca2+的物质的量浓度为______mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
在0.24 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题。
(1)该混合液中,NaCl的物质的量为______mol,含溶质MgCl2的质量为________g。
(2)该混合液中CaCl2的物质的量为________mol,将该混合液加水稀释至体积为1200mL,稀释后溶液中Ca2+的物质的量浓度为______mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。