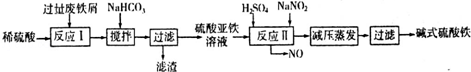
(1)大气中SO2含量过高会导致雨水中含有(填化学式) 而危害植物和建筑物。工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为 。
(2)已知NaHSO3的水溶液显酸性,比较其中SO32-、HSO3-、H2SO3三种粒子的浓度:
> > 。
(3)SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量。每生成0.01mol I2,参加反应的SO2为 mol。
(4)已知25℃时,Ksp(BaSO4)=1. 1×10-10,Ksp (BaCO3)=2.6×10-9。下列说法不正确的是
1×10-10,Ksp (BaCO3)=2.6×10-9。下列说法不正确的是
A.25℃时,向BaSO4悬浊液中加入大量水,Ksp(BaSO4)不变
B.25℃时,向BaSO4悬浊液中加入Na2CO3溶液后,BaSO4不可能转化为BaCO3
C.向Na2SO4中加入过量BaCl2溶液后,溶液中c(SO42-)降低为零
 C-CH2-C
C-CH2-C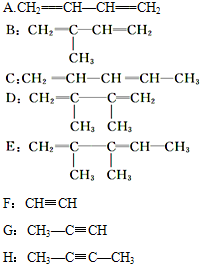
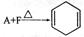 ,若要合成
,若要合成 ,则下列所选原料正确的是__。
,则下列所选原料正确的是__。
 LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 . 粤公网安备 44130202000953号
粤公网安备 44130202000953号