(16分) 物质的量是高中化学中常用的物理量,请完成以下有关其内容的计算:
(1)标准状况下,含有相同氧原子数的CO与CO2的体积之比为______。
(2)等温等压下,等体积的O2和O3所含分子个数比为________ ,原子个数比为________ ,质量比为________。
(3)设NA为阿伏加德罗常数的数值,如果a g某气中含有的分子数为b,则c g某气在标准状况下的体积约是________。 (用含NA的式子表示).
(4)配制100mL 1mol•L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g•mL-1,质量分数为98%)的体积为_______ mL.
(5)100 mL 某Al2(SO4)3溶液中,n(Al3+)=0.20 mol,则其中c(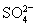 )= ______mol/L。
)= ______mol/L。
(6)某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数5.6%,300mL该溶液中Cl-的物质的量等于______ .