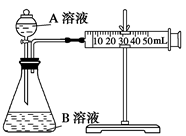
实验室需要配制480mL 1mol·L-1的硫酸溶液,其实验步骤为
①计算所需浓硫酸的体积;
②将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶中,轻轻的振荡;
③量取浓硫酸
④继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线相切
⑤用适量的蒸馏水稀释浓硫酸,冷却至室温;
⑥盖好瓶塞,摇匀;
根据上述信息回答问题:
(1)本实验操作步骤的正确顺序为___________
(2)若采用质量分数为98%(密度为1.84g·cm-3)的浓硫酸配制则需取用_____mL(保留小数点后一位);
(3)实验中用到的仪器除了量筒、烧杯、胶头滴管以外,还需要哪些仪器才能完成该实验__________;
(4)写出⑤中稀释硫酸的操作过程_________________________。
(5)如果实验遇到下列情况,对该硫酸物质的量浓度有何影响(填“偏高”、“偏低”或者“不变”)
①硫酸稀释后没有冷却至室温就转移至容量瓶并定容___________
②搅拌时不小心洒出一小滴溶液___________
③定容时俯视观察液面___________

 。
。
 mol/L
mol/L H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合
H2C2O4溶液,另取两支试管各加入4 mL 0.1 mol/L KMnO4溶液。将四支试管分成两组(各有一支盛有H2C2O4溶液和KMnO4溶液的试管),一组放入冷水中,另一组放入热水中,经过一段时间后,分别混合 并振荡,记录溶液褪色所需时间。该实验目的是研究对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是。
并振荡,记录溶液褪色所需时间。该实验目的是研究对化学反应速率的影响,但该组同学始终没有看到溶液褪色,其原因是。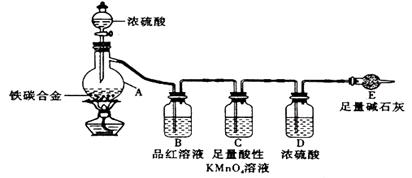
 _______________________________。
_______________________________。 热,拆下E并称重。E增重b g。铁碳合金中铁的质量分数为_____________________(写表达式)。
热,拆下E并称重。E增重b g。铁碳合金中铁的质量分数为_____________________(写表达式)。
 ⑦……。
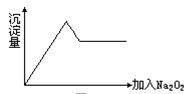
⑦……。 酸酸化的BaCl2溶液,只观察到有白色沉淀生成。
酸酸化的BaCl2溶液,只观察到有白色沉淀生成。 沉淀的量的关系如图所示:
沉淀的量的关系如图所示: 试问:
试问: 实验室利用下述实验装置探究Cl2性质并模拟制备漂水。
实验室利用下述实验装置探究Cl2性质并模拟制备漂水。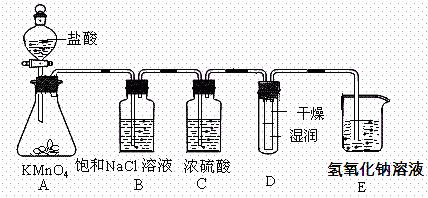
 __。
__。 导致的。请判断该解释是否合理,并分析产生上述实验现象的原因_________________
导致的。请判断该解释是否合理,并分析产生上述实验现象的原因_________________ 粤公网安备 44130202000953号
粤公网安备 44130202000953号