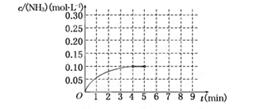
(本题共12分)CuSO4∙5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4∙5H2O的实验室制备流程圈。
根据题意完成下列填空:
41、向含铜粉的稀硫酸中滴加少量浓硝酸(可加热),在铜粉溶解时可以观察到的实验现象: 。
42、根据反应原理,硝酸与硫酸的理论配比(物质的量之比)为 。
43、已知:CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
称取0.1000g提纯后的CuSO4∙5H2O试样于锥形瓶中,加入0.1000mol/L氢氧化钠溶液28.00mL,反应完全后,过量的氢氧化钠用0.1000mol/L盐酸滴定至终点,耗用盐酸20.16mL,则0.1000g该试样中含CuSO4∙5H2O g。
44、在滴定中,眼睛应注视 ;滴定终点时,准确读数应该是滴定管上蓝线所对应的刻度。
45、若上述滴定操作中,滴定管加盐酸之前未进行润洗,则测得试样中所含CuSO4∙5H2O的质量 (填“偏大”“偏小”或“无影响”)。
46、如果l.040g提纯后的试样中含CuSO4∙5H2O的准确值为1.015g,而实验测定结果是1.000g,测定的相对误差为 。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.2
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
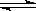 2HI(g) △H <0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)
2HI(g) △H <0。改变下列条件,反应速率将如何改变?(选填“增大”“减小”或“不变”)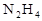 作燃料,
作燃料, 作氧化剂,两者反应生成N2和水蒸气,已知:
作氧化剂,两者反应生成N2和水蒸气,已知: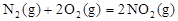 △H1=+67.7kJ/mol
△H1=+67.7kJ/mol 2NH3(g) ΔH<0
2NH3(g) ΔH<0