如图是甲、乙两种固体物质在水中的溶解度曲线.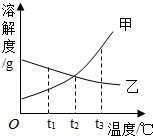
(1)t1℃时,甲的溶解度 乙的溶解度(填“<”、“>”或“=”).
(2)将t2℃时甲、乙的饱和溶液分别升温至t3℃,甲溶液中溶质的质量分数将 (填“增大”、“减小”或“不变”下同).乙溶液中溶质的质量分数将 .
(3)t2℃时,甲的饱和溶液中溶质的质量m甲与乙的饱和溶液中溶质的质量m乙相比较,
两者的大小关系是 (选填序号).
| A.m甲>m乙 | B.m甲<m乙 | C.m甲=m乙 | D.不确定. |
如图是甲、乙两种固体物质在水中的溶解度曲线.
(1)t1℃时,甲的溶解度 乙的溶解度(填“<”、“>”或“=”).
(2)将t2℃时甲、乙的饱和溶液分别升温至t3℃,甲溶液中溶质的质量分数将 (填“增大”、“减小”或“不变”下同).乙溶液中溶质的质量分数将 .
(3)t2℃时,甲的饱和溶液中溶质的质量m甲与乙的饱和溶液中溶质的质量m乙相比较,
两者的大小关系是 (选填序号).
| A.m甲>m乙 | B.m甲<m乙 | C.m甲=m乙 | D.不确定. |