科学兴趣小组想研究影响过氧化氢(H2O2)分解速度的因素。在四支试管中分别加入0.2克二氧化锰 (MnO2)粉末,然后加入等量的不同溶质质量分数的过氧化氢溶液,观察气泡产生的速度,记录如下: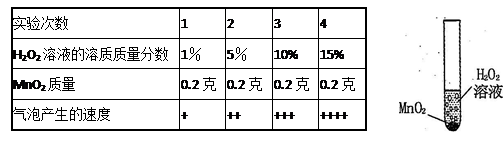
(1)该实验研究的问题是:过氧化氢分解的速度与_________的关系。 .
(2)为了检验产生的气体是否为氧气,请你写出检验的方法:____________________。
(3)实验完毕,可利用过滤法回收剩余溶液中的二氧化锰粉末。在过滤过程中,下列仪器不需要的有______________。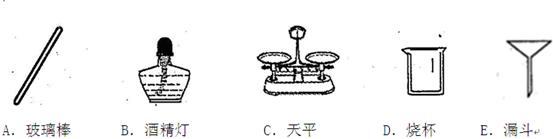
科学兴趣小组想研究影响过氧化氢(H2O2)分解速度的因素。在四支试管中分别加入0.2克二氧化锰 (MnO2)粉末,然后加入等量的不同溶质质量分数的过氧化氢溶液,观察气泡产生的速度,记录如下: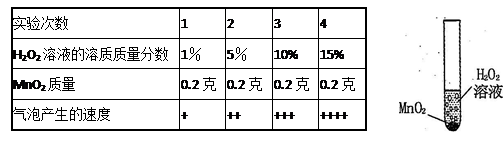
(1)该实验研究的问题是:过氧化氢分解的速度与_________的关系。 .
(2)为了检验产生的气体是否为氧气,请你写出检验的方法:____________________。
(3)实验完毕,可利用过滤法回收剩余溶液中的二氧化锰粉末。在过滤过程中,下列仪器不需要的有______________。