(12分)目前工业上可用CO2来生产燃料甲醇,其反应方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49kJ/mol。现进行如下实验:在体积为2 L的密闭容器中,充入2molCO2和6molH2,在一定温度下发生反应并达平衡,实验中测得CO2和CH3OH(g)的浓度随时间变化如图:
CH3OH(g)+H2O(g)△H=-49kJ/mol。现进行如下实验:在体积为2 L的密闭容器中,充入2molCO2和6molH2,在一定温度下发生反应并达平衡,实验中测得CO2和CH3OH(g)的浓度随时间变化如图:
(1)从反应开始到平衡,CO2的平均速率为 ;
(2)下列说法中正确的是 ;
A、某时刻时混合气体的密度、平均相对分子质量不变均可说明该反应达平衡状态
B、单位时间内消耗3mol H2的同时消耗1 mol CH3OH,可说明该反应达平衡状态
C、反应达平衡时H2的转化率为75%
D、2 mol CO2和6 mol H2反应达到平衡时放出98.0KJ热量
E、达平衡之后改变条件若平衡发生移动。该反应的平衡常数一定改变
(3)下列措施中既能加快该反应速率又能使CO2的转化率增大的是(填字母代号) ;
A、加入催化剂 B、升高温度 C、恒温恒容下充入He(g) D、再充入l mol CO2和3 mol H2
(4)该温度下的平衡常数为(用分数表示) ;
(5)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2 (g)+3H2 (g);△H=+49.0kJ/mol
②CH3OH(g)+1/2O2 (g)=CO2 (g)+2H2 (g);△H="-192.9" kJ/ mol
由此可推知:CH3OH(l)+1/2O2 (g)=CO2 (g)+2H2 (g)的△H -192.9 KJ/mol(填“>”“<”或“=”);又已知:H2O(g)= H2O (l);△H=-44.0 KJ/mol,则CH3OH(g)的燃烧热为 。
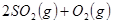

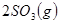 ,将
,将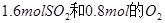 放入一体积可变的密闭容器中,测得容器的起始容积为
放入一体积可变的密闭容器中,测得容器的起始容积为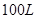 。经一段时间后,反应达到平衡,测得混合气体的体积为80L,请回答下列问题:
。经一段时间后,反应达到平衡,测得混合气体的体积为80L,请回答下列问题: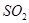 的转化率为______________;
的转化率为______________;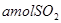 、
、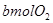 ,且
,且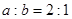 ,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为120L。则a、b的值分别为:a=_______,b=_______。
,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为120L。则a、b的值分别为:a=_______,b=_______。 、
、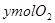 和
和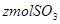 ,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则x、y应该满足的关系式为______________,x、z应该满足的关系式为_____________________。
,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则x、y应该满足的关系式为______________,x、z应该满足的关系式为_____________________。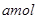
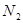 与
与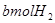 的混合气体通入一个固定容积的密闭容器中,发生如下反应:
的混合气体通入一个固定容积的密闭容器中,发生如下反应: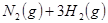

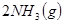
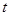 时,
时,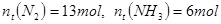 ,则a=_______。
,则a=_______。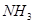 的含量(体积分数)为25%,平衡时
的含量(体积分数)为25%,平衡时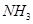 的物质的量__________。
的物质的量__________。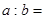 __________。
__________。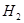 的转化率之比,
的转化率之比,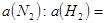 __________。
__________。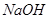 稀溶液中,
稀溶液中,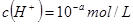 ,
,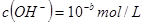 ,已知
,已知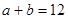 ,则:
,则: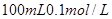 的稀硫酸与
的稀硫酸与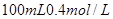 的
的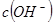 =_________。
=_________。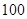 体积
体积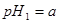 的某强酸溶液与1体积
的某强酸溶液与1体积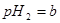 的某强碱溶液混合后溶液呈中性,则混合前,该强酸的
的某强碱溶液混合后溶液呈中性,则混合前,该强酸的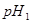 与强碱的
与强碱的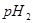 之间应满足的关系是_________。
之间应满足的关系是_________。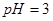 的硫酸溶液和
的硫酸溶液和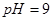 的
的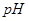 _________(填>7、=7、<7);
_________(填>7、=7、<7);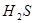 溶于水的电离方程式为___________________________。
溶于水的电离方程式为___________________________。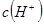 _________(填增大、减小、不变),
_________(填增大、减小、不变),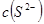 _________(填增大、减小、不变)。
_________(填增大、减小、不变)。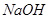 固体,电离平衡向_________移动,
固体,电离平衡向_________移动,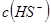 增大,且使
增大,且使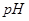 _________(填增大、减小、不变)
_________(填增大、减小、不变)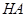 配制
配制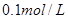 的溶液
的溶液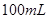 ;
;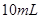 ,加水稀释为
,加水稀释为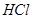 溶液的试管中放出
溶液的试管中放出 的速率快;
的速率快; 粤公网安备 44130202000953号
粤公网安备 44130202000953号