高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)已知:4FeO42-+10H2O 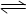 4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
4Fe(OH) 3+8OH-+3O2↑。K2FeO4在处理水的过程中所起的作用有 。
同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH= 的溶液。
(2)高铁酸钾有以下几种常见制备方法:
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 |
制备中间产物Na2FeO4,再与KOH溶液反应 |
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:____ ________________。
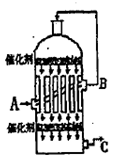
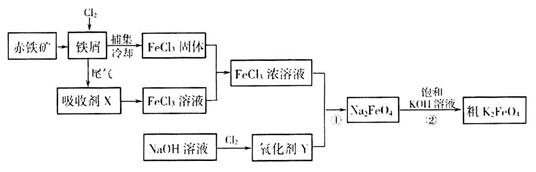
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应
式为 。
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O  3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为____ ,正极反应为:____ 。
(4) 25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000 L含有2.0×l0-4 mol·L-l K2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为____ mol。
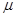 L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式
L/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式  CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
 (填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。 )+c(HCO
)+c(HCO )+c(H2CO3)
)+c(H2CO3) c(CO
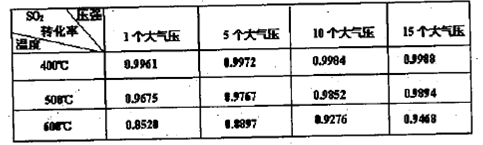
c(CO 则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
 2Fe(s)+3CO(g)△H=+489.0KJ·mol
2Fe(s)+3CO(g)△H=+489.0KJ·mol ;
;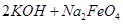 =
=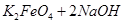 ,说明此温度下
,说明此温度下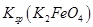 __________
__________  (填“>”或“<”)。
(填“>”或“<”)。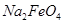 完全转化为
完全转化为 ,若最终制得粗产品
,若最终制得粗产品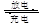 3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。
3Zn(OH)2+2Fe(OH)3+4KOH,放电时电池的负极反应式为______________________________________。 ,阿伏加德罗常数为
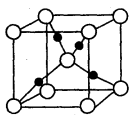
,阿伏加德罗常数为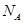 ,则晶胞边长为_______cm(用含
,则晶胞边长为_______cm(用含  、
、
 粤公网安备 44130202000953号
粤公网安备 44130202000953号