(11)E的产量是衡量一个国家石油化工发展水平的标志,并能进行如图所示的反应。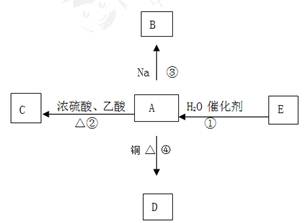
(1)写出A的官能团名称
(2)下列反应的化学方程式
反应①: 发生的反应类型
反应②: 发生的反应类型
反应④: 发生的反应类型
(3)比较:反应①剧烈程度 (填>、= 或<)钠和水反应的剧烈程度
(11)E的产量是衡量一个国家石油化工发展水平的标志,并能进行如图所示的反应。
(1)写出A的官能团名称
(2)下列反应的化学方程式
反应①: 发生的反应类型
反应②: 发生的反应类型
反应④: 发生的反应类型
(3)比较:反应①剧烈程度 (填>、= 或<)钠和水反应的剧烈程度