氮元素可以形成多种化合物。
(1)基态氮原子的价电子轨道表示式是 。
(2)已知尿素的结构式为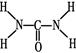 ,则尿素分子中C和N原子的杂化方式分别是、。
,则尿素分子中C和N原子的杂化方式分别是、。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①NH3分子的空间构型是;
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)△H=-1038.7kJ·mol-1
当肼燃烧放出519.35kJ热量时,形成的π键有mol。
氮元素可以形成多种化合物。
(1)基态氮原子的价电子轨道表示式是 。
(2)已知尿素的结构式为 ,则尿素分子中C和N原子的杂化方式分别是、。
,则尿素分子中C和N原子的杂化方式分别是、。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮化物。
①NH3分子的空间构型是;
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)△H=-1038.7kJ·mol-1
当肼燃烧放出519.35kJ热量时,形成的π键有mol。