白磷(P4)分子为正四面体型分子,如图所示,4个P原子位于正四面体的四个顶点,请回答下列问题: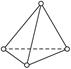
(1)分子中P—P键之间的夹角为__________;
(2)1 mol P4分子中有__________mol P—P键;
(3)P4分子是__________(填极性或非极性)分子。
白磷(P4)分子为正四面体型分子,如图所示,4个P原子位于正四面体的四个顶点,请回答下列问题:
(1)分子中P—P键之间的夹角为__________;
(2)1 mol P4分子中有__________mol P—P键;
(3)P4分子是__________(填极性或非极性)分子。