如右图,A为直流电源,c、d均为石墨电极, B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空: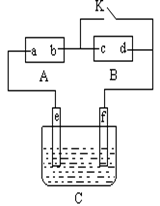
(1)电源A上的a为________极;
(2)滤纸B上发生的总化学方程式为___________________;
(3)欲在电镀槽中实现铁上镀锌,闭合K键,使c、d两点短路,则电极e上发生的反应为 ,电极f上发生的反应为___________________,槽中放的电镀液可以是 。
如右图,A为直流电源,c、d均为石墨电极, B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
(1)电源A上的a为________极;
(2)滤纸B上发生的总化学方程式为___________________;
(3)欲在电镀槽中实现铁上镀锌,闭合K键,使c、d两点短路,则电极e上发生的反应为 ,电极f上发生的反应为___________________,槽中放的电镀液可以是 。