在某些酶的催化下,人体内葡萄糖的代谢有如下过程:
请填空:
(1)过程①是________反应,过程②是________反应,过程③是________反应(填写反应类型的名称).
(2)过程④的另一种生成物是________(填写化学式).
(3)上述物质中________和________互为同分异构体(填写字母代号).
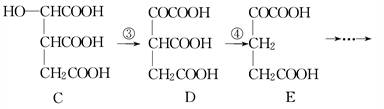
在某些酶的催化下,人体内葡萄糖的代谢有如下过程:

请填空:
(1)过程①是________反应,过程②是________反应,过程③是________反应(填写反应类型的名称).
(2)过程④的另一种生成物是________(填写化学式).
(3)上述物质中________和________互为同分异构体(填写字母代号).