氨气在科研、生产中有广泛应用。

(1)在三个1L的恒容密闭容器中,分别加入0.1mol N2和0.3mol H2发生反应N2(g)+3H2(g) 2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
2NH3(g)ΔH1<0,实验Ⅰ、Ⅱ、Ⅲ中c(N2)随时间(t)的变化如图所示(T表示温度)。
①实验Ⅲ在前10分钟内N2平均反应速率v(N2)= ;(写出计算过程)
②与实验Ⅱ相比,实验Ⅰ、实验Ⅲ分别采用的实验条件可能为 、 。
(2)常温下NH4+(aq)+H2O(l) NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。
NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol·L-1,则NH3•H2O的电离平衡常数K= (保留三位有效数字)。
(3)常温下,将1mL pH均为11的氨水与NaOH溶液分别加水稀释,请在右图中画出两溶液的pH随体积稀释倍数的变化曲线(加必要标注)。
(4)工业上用NH3消除NO污染。在一定条件下,已知每还原1molNO,放出热量120kJ,请完成下列热化学方程式: NO(g)+ NH3(g)= N2(g)+ (g) ΔH2= 。
粤ICP备20024846号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
 粤公网安备 44130202000953号
粤公网安备 44130202000953号
Copyright ©2020-2024 优题课 youtike.com 版权所有
Powered by:Youtike Platform 6.6.3
声明:本网站部分内容由互联网用户自发贡献自行上传,本网站不拥有所有权,也不承担相关法律责任。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
如果您发现有涉嫌版权的内容,欢迎发送邮件至:service@youtike.com 或 联系QQ:267757 进行举报,一经查实,本站将立刻删除涉嫌侵权内容。
 [CuCl4]2-+4H2O
[CuCl4]2-+4H2O )的等式: 。
)的等式: 。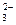 )的等式: 。
)的等式: 。