黄铜矿(CuFeS2)是炼钢和炼铜的主要原料.在高温下灼烧生成二氰化二铁和氧化铜。三氧化二铁和氧化亚铜都是红色粉末.常用作颜料。某学校化学兴趣小组通过实验米探究一红色粉末是Fe2O3、Cu2O或两者的混合物。探究过程如下:
【查阅资料】Cu2O是一种碱性氧化物.溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
【提出假设】
假设1:红色粉末是Fe2O3。假设2:红色粉末是Cu2O。假设3:红色粉末是Fe2O3和Cu2O的混合物。
【设计探究实验】
取少量粉末放入足量稀硫酸中.在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是 。
(2)滴加KSCN试剂后溶液不变红色.某同学认为原同体粉末中一定不含三氧化二铁。你认为这种说法合理吗? 。简述你的理由(不需写出反应的化学方程式): 。
(3)若固体粉末未完全溶解,仍然有固体存在.滴加KSCN试剂时溶液不变红色.则证明原固体粉末是 ,写出发生的氧化还原反应的离子方程式: 。
【探究延伸】
(4)经过实验分析.确定红色粉末为Fe2O3和Cu2O的混合物。实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经过查阅资料得知.在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
实验小组设汁如下实验方案:
①试剂1为 .试剂2为 . (填字母)
| A.氯水 | B.H2O2 | C.NaOH | D.CuO |
②固体X的化学式为 。
③操作II为 。
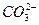 、
、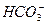 、Cl-中的一种或几种,向其中滴加过量的BaCl2溶液,未见明显现象;又向混合溶液中滴加NaOH溶液时,溶液中产生了白色沉淀;再向固液混合物中滴加足量稀盐酸时,白色沉淀溶解,溶液中逸出无色、无味的气体,将该气体导入澄清的石灰水后,石灰水中产生了白色沉淀。原无色溶液中肯定存在的离子是什么?若向原无色溶液中直接滴加稀盐酸时,有何现象?
、Cl-中的一种或几种,向其中滴加过量的BaCl2溶液,未见明显现象;又向混合溶液中滴加NaOH溶液时,溶液中产生了白色沉淀;再向固液混合物中滴加足量稀盐酸时,白色沉淀溶解,溶液中逸出无色、无味的气体,将该气体导入澄清的石灰水后,石灰水中产生了白色沉淀。原无色溶液中肯定存在的离子是什么?若向原无色溶液中直接滴加稀盐酸时,有何现象?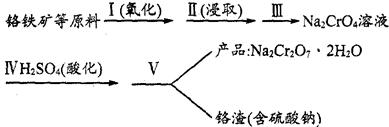
 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。

 (1)
(1) ,反应的氧化剂是______________,氧化产物为__________
,反应的氧化剂是______________,氧化产物为__________ 逐渐下降,
逐渐下降, 、
、 会逐渐增加,所以需定时除去其中的
会逐渐增加,所以需定时除去其中的 、
、 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。









 生成
生成 粤公网安备 44130202000953号
粤公网安备 44130202000953号