有一无色溶液,可能含有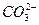 、
、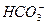 、Cl-中的一种或几种,向其中滴加过量的BaCl2溶液,未见明显现象;又向混合溶液中滴加NaOH溶液时,溶液中产生了白色沉淀;再向固液混合物中滴加足量稀盐酸时,白色沉淀溶解,溶液中逸出无色、无味的气体,将该气体导入澄清的石灰水后,石灰水中产生了白色沉淀。原无色溶液中肯定存在的离子是什么?若向原无色溶液中直接滴加稀盐酸时,有何现象?
、Cl-中的一种或几种,向其中滴加过量的BaCl2溶液,未见明显现象;又向混合溶液中滴加NaOH溶液时,溶液中产生了白色沉淀;再向固液混合物中滴加足量稀盐酸时,白色沉淀溶解,溶液中逸出无色、无味的气体,将该气体导入澄清的石灰水后,石灰水中产生了白色沉淀。原无色溶液中肯定存在的离子是什么?若向原无色溶液中直接滴加稀盐酸时,有何现象?
有一无色溶液,可能含有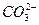 、
、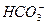 、Cl-中的一种或几种,向其中滴加过量的BaCl2溶液,未见明显现象;又向混合溶液中滴加NaOH溶液时,溶液中产生了白色沉淀;再向固液混合物中滴加足量稀盐酸时,白色沉淀溶解,溶液中逸出无色、无味的气体,将该气体导入澄清的石灰水后,石灰水中产生了白色沉淀。原无色溶液中肯定存在的离子是什么?若向原无色溶液中直接滴加稀盐酸时,有何现象?
、Cl-中的一种或几种,向其中滴加过量的BaCl2溶液,未见明显现象;又向混合溶液中滴加NaOH溶液时,溶液中产生了白色沉淀;再向固液混合物中滴加足量稀盐酸时,白色沉淀溶解,溶液中逸出无色、无味的气体,将该气体导入澄清的石灰水后,石灰水中产生了白色沉淀。原无色溶液中肯定存在的离子是什么?若向原无色溶液中直接滴加稀盐酸时,有何现象?