一定条件下,在体积为5 L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如图1所示。已知达平衡后,降低温度,A的体积百分含量将减小。
(1)根据上图数据,写出反应的化学方程式 ;
从反应开始到平衡时的平均速率v(C)= 。
(2)该反应的ΔH 0(填“>”、“<”或“=”)。
(3)此反应平衡常数的表达式为K= 。
(4)该反应的反应速率v和时间t的关系如图2所示: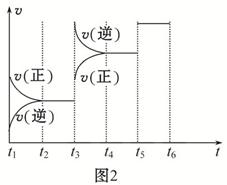
①根据上图判断,在t3时刻改变的外界条件是 。
②A的转化率最大的一段时间是 。
③各阶段的平衡常数如表所示:
K1、K2、K3之间的关系为: (用“>”、“<”或“=”连接)。
相关知识点




 粤公网安备 44130202000953号
粤公网安备 44130202000953号