(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g)△H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g)△H="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
 浓度 浓度
|
0
|
10
|
20
|
30
|
40
|
50
|
NO
|
1.00
|
0.68
|
0.50
|
0.50
|
0.60
|
0.60
|
N2
|
0
|
0.16
|
0.25
|
0.25
|
0.30
|
0.30
|
CO2
|
0
|
0.16
|
0.25
|
0.25
|
0.30
|
0.30
|
①0~10min内,NO的平均反应速率v(NO)=,T1℃时,该反应的平衡常数K=。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是(填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,Q0
(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是(填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.混合气体的平均相对分子质量不再改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
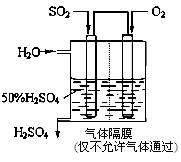
(2)若以下图所示装置,用电化学原理生产硫酸,写出通入SO2电极的电极发生(填“氧化”或“还原”)反应,电极反应式为。