某小组查文献得知:氧化性I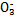 >Fe3+>I2,3Br2+6FeCl2
>Fe3+>I2,3Br2+6FeCl2 2FeBr3+4FeCl3;I2+2S2
2FeBr3+4FeCl3;I2+2S2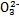
 S4
S4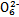 +2I-;CuI是一种白色沉淀(Ksp=1.3×1
+2I-;CuI是一种白色沉淀(Ksp=1.3×1 )。
)。
Ⅰ.该小组为确定一份加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)的成分,设计定性实验加以猜想和验证。
(1)实验过程如下:
| 实验步骤 |
实验过程和现象 |
对应结论 |
|
| 步骤1 |
取一定量碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份 |
_____________ |
|
| 步 骤 2 |
第①份 试液 |
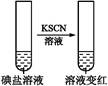 |
碘盐中肯定含 |
| 第②份 试液 |
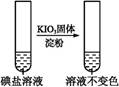 |
_____________ |
|
| 第③份 试液 |
 |
X为 (填化学式) |
(2)该碘盐中肯定不含的物质是 (用化学式或离子符号表达)。
(3)根据信息推断Fe3+、S4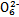 、I2、Br2的氧化性由强到弱的顺序是 。
、I2、Br2的氧化性由强到弱的顺序是 。
(4)第③份试液中加入足量KI固体后,反应的离子方程式为 、 。
Ⅱ.用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:
取0.40 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。加入淀粉作滴定指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
(1)滴定终点的现象是 。
(2)CuCl2溶液与KI反应的化学方程式为 。
(3)该试样中CuCl2·2H2O的质量分数为 。
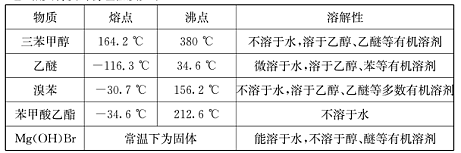
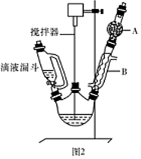
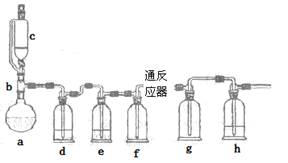
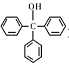 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图所示。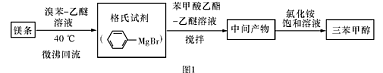
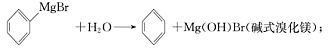

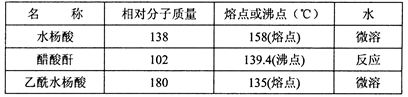
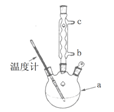
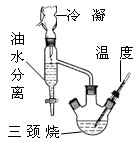
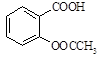 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: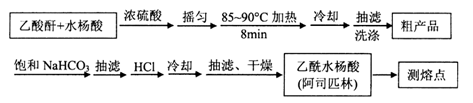
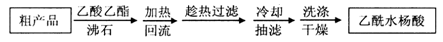
 粤公网安备 44130202000953号
粤公网安备 44130202000953号