亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)写出亚硝酸的电离方程式: 。
(2)在酸性条件下,当NaNO2与KI按物质的量之比1∶1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为 (填化学式)。
(3)要得到稳定的HNO2溶液,可以向冷冻的NaNO2浓溶液中加入或通入某种物质,下列物质不适合的是 (填字母)。
a.稀硫酸 b.二氧化碳 c.二氧化硫 d.磷酸
(4)碱性工业废水中的N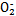 可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
可用铝粉除去。已知此反应体系中含有Al、NaAlO2、NaNO2、NaOH、NH3·H2O、H2O六种物质。
①写出上述反应的离子方程式: 。
②发生上述反应后废水的pH将 (填“增大”“减小”或“不变”)。
(5)酸性工业废水中的N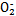 可用尿素除去。尿素
可用尿素除去。尿素
(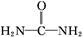 )与N
)与N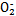 在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。
在酸性条件下反应生成两种无毒气体。该反应中生成16.8 L(已折算为标准状况)混合气体时,消耗尿素的质量为 g。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号