常温下,如果取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(忽略混合后
溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因: (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) (填“>”“<”或“=”)0.1 mol/L NaOH
溶液中由水电离出的c(H+)。
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)= mol/L,
c(OH-)-c(HA) = mol/L。
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3
溶液的pH (填“大于”“小于”或“等于”)7;将同温度下等浓度的四
种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列是 (填序号)。
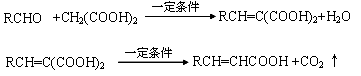
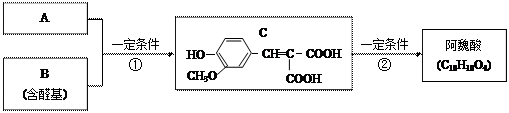
 等物质的量C分别与足量的Na、浓溴水、NaOH、NaHCO3反应时消耗Na、Br2、NaOH、NaHCO3的物质的量之比是________________
等物质的量C分别与足量的Na、浓溴水、NaOH、NaHCO3反应时消耗Na、Br2、NaOH、NaHCO3的物质的量之比是________________ 用阿魏酸在一定条件下生成抗氧化性的高分子化合物的方程式:
用阿魏酸在一定条件下生成抗氧化性的高分子化合物的方程式: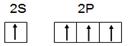 ,请判断对错,并加以解释
,请判断对错,并加以解释  电子式___________
电子式___________  CO2(g) + H2(g) △H=_____________。
CO2(g) + H2(g) △H=_____________。 _____________。
_____________。 (g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变,
(g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变, 增大容器的体积,则平衡_________(填字母)
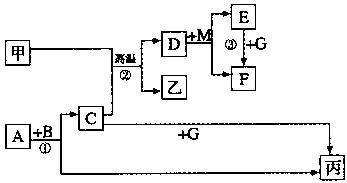
增大容器的体积,则平衡_________(填字母) 得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)
得到H溶液,该无氧酸的阴离子在同主族元素形成的简单阴离子中还原性最强(除放射性元素)。其物质间转化关系如下图:(部分反应物和生成物略去)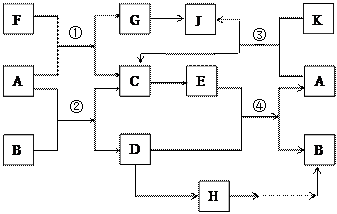

 粤公网安备 44130202000953号
粤公网安备 44130202000953号