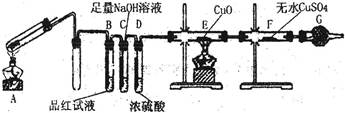
某兴趣小组研究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
(1)SO2气体与Fe3+反应的主要产物是__ __ 。(填离子符号)
(2)下列实验方案可以用于在实验室制取所需SO2的是 。
| A.Na2SO3溶液与HNO3 | B.Na2SO3固体与浓硫酸 |
| C.固体硫在纯氧中燃烧 | D.铜与热浓H2SO4 |
(3)装置C的作用是 。
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为 mol/L才能达到目的。
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀。
上述方案不合理的是 ,原因是 。
(6)能表明I—的还原性弱于SO2的现象是 ,写出有关离子方程式: 。

 + 28KMnO4 + 42H2SO4
+ 28KMnO4 + 42H2SO4 28MnSO4 + 14K2SO4 + 30CO2↑+ 57H2O
28MnSO4 + 14K2SO4 + 30CO2↑+ 57H2O 粤公网安备 44130202000953号
粤公网安备 44130202000953号