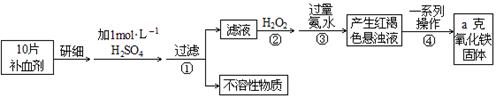
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
| 实验编号 |
反应物 |
催化剂 |
| ① |
10mL2% H2O2溶液 |
无 |
| ② |
10mL5% H2O2溶液 |
无 |
| ③ |
10mL5% H2O2溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ④ |
10mL5% H2O2溶液+少量HCl溶液 |
1mL0.1mol·L-1FeCl3溶液 |
| ⑤ |
10mL5% H2O2溶液+少量NaOH溶液 |
1mL0.1mol·L-1FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_ .
(2)常温下5% H2O2溶液的pH约为6,H2O2的电离方程式为 .
(3)实验①和②的目的是__________________________________________.
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图.
分析上图能够得出的实验结论是 .
 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: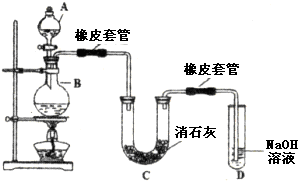
 产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应: ,为避免此副反应的发生,可采取的措施是______________________________。
,为避免此副反应的发生,可采取的措施是______________________________。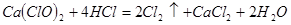 ,该反应中每生成
,该反应中每生成 ,转移电子的物质的量为__________
,转移电子的物质的量为__________ ,被氧化的
,被氧化的 的物质的量为__________
的物质的量为__________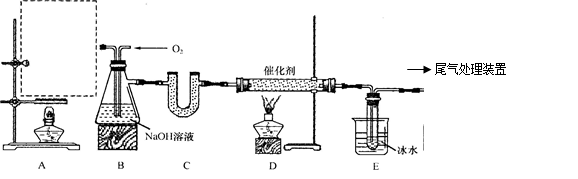

 粤公网安备 44130202000953号
粤公网安备 44130202000953号