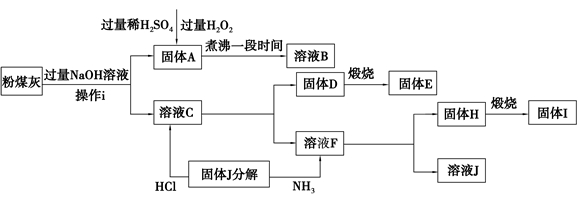
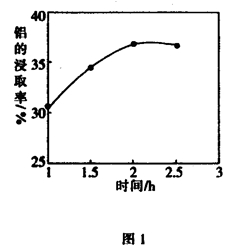
工业上常利用低品位软锰矿浆(主要成分是MnO2)来吸收含SO2的废气,最终制得硫酸锰晶体(MnSO4·H2O),其主要流程如下:
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时溶液的pH见下表:
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
7.6 |
9.7 |
| Fe3+ |
2.7 |
3.7 |
| Al3+ |
3.8 |
4.7 |
| Mn2+ |
8.3 |
9.8 |
(1)软锰矿浆中通入含SO2废气后,发生主要反应的化学方程式为____________________。
(2)浸出液中加入MnO2粉末的目的是____________;反应的离子方程式是___________________。
(3)溶液中加入石灰浆来调节pH,其作用是_________________;pH应调节的范围是__________。
(4)滤渣的主要成分是________________________________________________(用化学式表示)。
 2NO2,△H >0隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2,△H >0隔一段时间对该容器内的物质进行分析,得到如下数据:


 2[Al(OH)4]―+ 3Ag,则该电池工作时正极的电极反应方程式为 ,若电池产生6mol电子转移,整体上分析电池负极消耗的OH―物质的量最终为 mol。
2[Al(OH)4]―+ 3Ag,则该电池工作时正极的电极反应方程式为 ,若电池产生6mol电子转移,整体上分析电池负极消耗的OH―物质的量最终为 mol。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号