许多含氯物质与生活密切相关,如HC10、C102、NaClO2等都是重要的杀菌消毒剂和漂白剂。下列是重要的含氯漂白剂NaClO2的工业合成流程图。
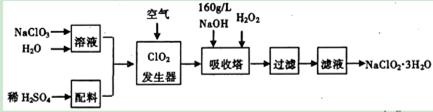
已知:纯ClO2易发生爆炸。请回答下列问题:
(1) 在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是____________。
(2)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中,除用H2O2外,还可以选择的还原剂是______(填代号)。
a.Na2O2 b.Na2S c.FeCl2 d.铁粉
(3)NaClO2溶液与FeCl2溶液相遇,有大量红褐色沉淀产生,该反应的离子方程式为______
(4)为了测定NaClO2 • 3H2O的纯度,取上述合成产品10 g溶于水配成500 mL溶液,取出10 mL溶液于锥形瓶中,再加人足量酸化的KI溶液,充分反应后加人2 ~3滴淀粉溶液,用0.264 mol/L Na2S2O3标准液滴定,锥形瓶中溶液______(填颜色变化),且半分钟内不发生变化,说明滴定达终点,用去标准液20.OOmL,试样纯度是否合格______(填“合格”或“不合格”,合格纯度在90%以上)。提示: 。
。