水是宝贵资源,研究生活和工业用水的处理有重要意义。请回答下列问题:
(1)已知水的电离平衡曲线如图所示。A、B、C三点水的电离平衡常数KA、KB、KC关系为 ,若从B点到D点,可采用的措施是 (填序号)。
(填序号)。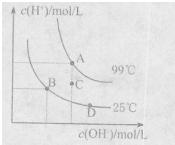
a。加入少量盐酸
b.加人少量碳酸钠
c.加人少量氢氧化钠
d.降低温度
(2)饮用水中的NO3-主要来自于NH4+。已知在微生物的作用下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下: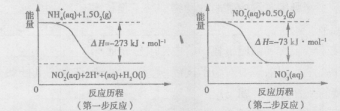
1 molNH4+全部被氧化成NO3-的热化学方程式为 。
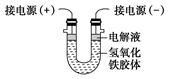
(3)某工厂用电解法除去废水中含有的Cr2O72-,总反应方程式为:
Cr2O72-+6Fe+17H2O+2H+ 2Cr(OH)3↓+6Fe(OH)3↓+6H2↑,该电解反应的负极材料反应的电极式为 ,若有9 mol电子发生转移,则生成的cr(OH)3物质的量为 。
(4)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中。常含有较多的NH4+和PO43-,其中一种方法是:在废水中加人镁矿工业废水,可以生成高品位的磷矿石——鸟粪石,反应的离子方程式为Mg2++NH4++PO43- MgNH4PO4↓。该方法中需要控制污水的pH为7.5—10,若pH高于l0.7,鸟粪石产量会降;低,其原因可能是 。



 粤公网安备 44130202000953号
粤公网安备 44130202000953号