已知下列两个反应①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)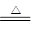 CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:
(1)反应①中 元素被还原,反应②中 元素被还原.
(2)当反应①生成2gH2时,消耗H2SO4的物质的量是 。
(3)反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为 ,若有4mol H2SO4参加反应时,被还原元素的质量是 g。
已知下列两个反应①Fe+H2SO4(稀)=FeSO4+H2↑
②Cu+2H2SO4(浓)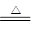 CuSO4+SO2↑+2H2O。试回答下列问题:
CuSO4+SO2↑+2H2O。试回答下列问题:
(1)反应①中 元素被还原,反应②中 元素被还原.
(2)当反应①生成2gH2时,消耗H2SO4的物质的量是 。
(3)反应②若有1mol H2SO4作氧化剂时,转移电子的物质的量为 ,若有4mol H2SO4参加反应时,被还原元素的质量是 g。