将镁、铝的混合物7.8 g溶于100 mL 6 mol/L的H2SO4溶液中,然后再滴加2 mol/L的NaOH溶液。请回答: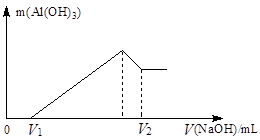
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积V变化如下图所示。当V1=200 mL时,则金属粉末中,n(Mg)=_________mol,V2=__________mL。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、A13+刚好沉淀完全,则滴入NaOH溶液的体积为__________mL。
将镁、铝的混合物7.8 g溶于100 mL 6 mol/L的H2SO4溶液中,然后再滴加2 mol/L的NaOH溶液。请回答: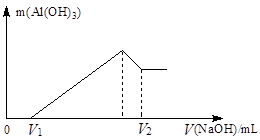
(1)若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液的体积V变化如下图所示。当V1=200 mL时,则金属粉末中,n(Mg)=_________mol,V2=__________mL。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、A13+刚好沉淀完全,则滴入NaOH溶液的体积为__________mL。