(12分) 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)基态钛原子的核外电子排布式为 。
(2)TiCl4在常温下呈液态,而FeCl3可用升华法提纯,则两种氯化物均属于 晶体。
(3)SO42—和 S2O82—(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 。
A.SO42—中存在σ键和π键且与PO43—离子互为等电子体
B.S2O82—中存在非极性键且有强氧化性
C.S2O82—比SO42—稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ,原因是 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ,分子的空间构型为 。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 。
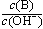 b.
b. c.c(H+)·c(OH-) d.n(OH-)
c.c(H+)·c(OH-) d.n(OH-)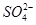 的立体构型是________,其中S原子的杂化轨道类型是_______;
的立体构型是________,其中S原子的杂化轨道类型是_______;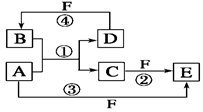
 粤公网安备 44130202000953号
粤公网安备 44130202000953号