图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上
一氯取代位置有三种。
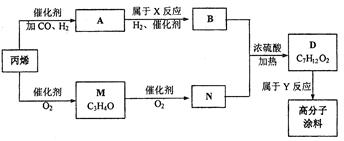
(1)试写出下列物质的结构简式:A M
(2)写出反应N+B D的化学方程式:
D的化学方程式:
(3)写出反应类型:x ,Y
图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上
一氯取代位置有三种。

(1)试写出下列物质的结构简式:A M
(2)写出反应N+B D的化学方程式:
D的化学方程式:
(3)写出反应类型:x ,Y