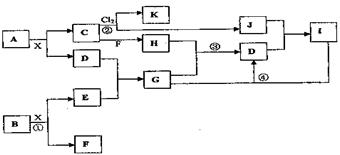
请按要求回答:
(1)写出A的化学式 H的电子式
(2)反应①中每生成l mol F,转移电子的物质的量为
(3)反应②进行的条件为
(4)反应③的化学方程式为
(5)反应④的离子方程式为

请按要求回答:
(1)写出A的化学式 H的电子式
(2)反应①中每生成l mol F,转移电子的物质的量为
(3)反应②进行的条件为
(4)反应③的化学方程式为
(5)反应④的离子方程式为