碳元素是构成有机物的基础元素。
(1)写出碳元素核外电子排布式 。
(2)甲烷与水分子相对分子质量差距不大但溶沸点却有很大差距,原因是 。
(3)分析甲烷、乙烯、乙炔中碳原子杂化方式 。
(4)已知CO2晶胞结构如下,已知其晶胞边长为a cm,NA表示阿伏加德罗常数,其密度为 g/cm3。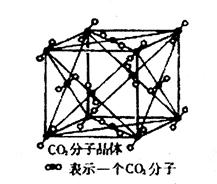
碳元素是构成有机物的基础元素。
(1)写出碳元素核外电子排布式 。
(2)甲烷与水分子相对分子质量差距不大但溶沸点却有很大差距,原因是 。
(3)分析甲烷、乙烯、乙炔中碳原子杂化方式 。
(4)已知CO2晶胞结构如下,已知其晶胞边长为a cm,NA表示阿伏加德罗常数,其密度为 g/cm3。