在密闭 容器中进行可逆反应: CO(g)+NO2(g)
容器中进行可逆反应: CO(g)+NO2(g)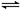 CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通入CO2气体,平衡 移动,反应混合物的颜色 。
若通入N2气体,平衡 移动,反应混合物的颜色 。 ③加入催化剂,平衡 移动。
在密闭 容器中进行可逆反应: CO(g)+NO2(g)
容器中进行可逆反应: CO(g)+NO2(g)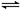 CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通入CO2气体,平衡 移动,反应混合物的颜色 。
若通入N2气体,平衡 移动,反应混合物的颜色 。 ③加入催化剂,平衡 移动。